第二部【企業情報】
第1【企業の概況】
1【主要な経営指標等の推移】
|
回次 |
第16期 |
第17期 |
第18期 |
第19期 |
第20期 |
|
|
決算年月 |
2021年3月 |
2022年3月 |
2023年3月 |
2024年3月 |
2025年3月 |
|
|
事業収益 |
(千円) |
|
|
|
|
|
|
経常損失(△) |
(千円) |
△ |
△ |
△ |
△ |
△ |
|
当期純損失(△) |
(千円) |
△ |
△ |
△ |
△ |
△ |
|
持分法を適用した場合の投資利益 |
(千円) |
|
|
|
|
|
|
資本金 |
(千円) |
|
|
|
|
|
|
発行済株式総数 |
(株) |
|
|
|
|
|
|
うち普通株式 |
(株) |
|
|
|
|
|
|
うちA種優先株式 |
(株) |
|
|
|
|
|
|
うちB種優先株式 |
(株) |
|
|
|
|
|
|
うちC種優先株式 |
(株) |
|
|
|
|
|
|
うちD種優先株式 |
(株) |
|
|
|
|
|
|
うちE種優先株式 |
(株) |
|
|
|
|
|
|
うちE2種優先株式 |
(株) |
|
|
|
|
|
|
うちE3種優先株式 |
(株) |
|
|
|
|
|
|
うちF種優先株式 |
(株) |
- |
- |
- |
- |
- |
|
純資産額 |
(千円) |
|
|
|
|
|
|
総資産額 |
(千円) |
|
|
|
|
|
|
1株当たり純資産額 |
(円) |
△ |
△ |
△ |
△ |
△ |
|
1株当たり配当額 |
(円) |
|
|
|
|
|
|
(うち1株当たり中間配当額) |
( |
( |
( |
( |
( |
|
|
1株当たり当期純損失(△) |
(円) |
△ |
△ |
△ |
△ |
△ |
|
潜在株式調整後1株当たり当期純利益 |
(円) |
|
|
|
|
|
|
自己資本比率 |
(%) |
|
|
△ |
△ |
|
|
自己資本利益率 |
(%) |
|
|
|
|
|
|
株価収益率 |
(倍) |
|
|
|
|
|
|
配当性向 |
(%) |
|
|
|
|
|
|
営業活動によるキャッシュ・フロー |
(千円) |
|
|
|
△ |
△ |
|
投資活動によるキャッシュ・フロー |
(千円) |
|
|
|
△ |
△ |
|
財務活動によるキャッシュ・フロー |
(千円) |
|
|
|
|
|
|
現金及び現金同等物の期末残高 |
(千円) |
|
|
|
|
|
|
従業員数 |
(名) |
|
|
|
|
|
|
〔外、平均臨時雇用者数〕 |
〔 |
〔 |
〔 |
〔 |
〔 |
|
(注)1. 当社は連結財務諸表を作成しておりませんので、連結会計年度に係る主要な経営指標等の推移については記載しておりません。
2. 持分法を適用した場合の投資利益については、関連会社が存在しないため記載しておりません。
3. 1株当たり配当額(うち1株当たり中間配当額)及び配当性向については、配当を実施していないため、記載しておりません。
4. 潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、当社株式は非上場であり、期中平均株価が把握できないため、また、1株当たり当期純損失であるため、記載しておりません。
5. 「収益認識に関する会計基準」(企業会計基準第29号 2020年3月31日)等を第17期の期首から適用しており、第17期以降に係る主要な経営指標等については、当該会計基準等を適用した後の指標等となっております。
6. 第16期、第17期及び第18期については、キャッシュ・フロー計算書を作成していないため、キャッシュ・フローに係る各項目を記載しておりません。
7. 自己資本利益率については、当期純損失であるため、記載しておりません。
8. 株価収益率については、当社株式は非上場であるため、記載しておりません。
9. 従業員数は就業人員(委任契約である参与を含む)を記載しております。また、臨時従業員(アルバイト、パートタイマーを含み、派遣社員は除く)は、年間の平均人員を〔〕内に外数で記載しております。
10.前事業年度(第19期)及び当事業年度(第20期)の財務諸表については、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、監査法人銀河の監査を受けております。なお、第16期、第17期及び第18期については、「会社計算規則」(平成18年法務省令第13号)の規定に基づき算出した各数値を記載しており、これらの数値は金融商品取引法第193条の2第1項の規定に基づく、監査法人銀河の監査を受けておりません。
11. 2025年11月27日開催の取締役会において、普通株式を対価とする取得条項に基づき、2025年12月16日付で、A種優先株式62,500株、B種優先株式127,903株、C種優先株式177,500株、D種優先株式545,000株、E種優先株式477,800株、E2種優先株式175,000株、E3種優先株式442,000株及びF種優先株式76,360株を自己株式として取得し、対価として、当該A種優先株主に普通株式62,500株、B種優先株主に普通株式127,903株、C種優先株主に普通株式177,500株、D種優先株主に普通株式681,250株、E種優先株主に普通株式477,800株、E2種優先株主に普通株式175,000株、E3種優先株主に普通株式442,000株及びF種優先株主に普通株式76,360株を交付しております。また、取得請求権行使により、2025年12月15日付で、D種優先株式124,200株、E2種優先株式200,000株を自己株式として取得し、対価としてD種優先株主に普通株式155,249株、E2種優先株主に普通株式200,000株を交付しております。当社が取得したA種優先株式、B種優先株式、C種優先株式、D種優先株式、E種優先株式、E2種優先株式、E3種優先株式、及びF種優先株式の全てについて、2025年12月17日開催の取締役会決議により同日付で消却しております。なお、当社は、2025年12月26日開催の臨時株主総会により、種類株式を発行する旨の定款の定めを廃止しております。
12.2026年1月29日付で普通株式1株につき5株の株式分割を行っております。第19期の期首に当該株式分割が行われたと仮定し、1株当たり純資産額及び1株当たり当期純損失を算定しております。
13.2026年1月29日付で普通株式1株につき5株の株式分割を行っております。
そこで、東京証券取引所自主規制法人(現 日本取引所自主規制法人)の引受担当者宛通知「『新規上場申請のための有価証券報告書(Ⅰの部)』の作成上の留意点について」(平成24年8月21日付東証上審第133号)に基づき、第16期の期首に当該株式分割が行われたと仮定して算定した場合の1株当たり指標の推移を参考までに掲げると以下のとおりとなります。なお、第16期、第17期及び第18期の数値(1株当たり配当額についてはすべての数値)については、監査法人銀河の監査を受けておりません。
|
回次 |
第16期 |
第17期 |
第18期 |
第19期 |
第20期 |
|
|
決算年月 |
2021年3月 |
2022年3月 |
2023年3月 |
2024年3月 |
2025年3月 |
|
|
1株当たり純資産額 |
(円) |
△469.32 |
△608.48 |
△789.60 |
△926.67 |
△734.62 |
|
1株当たり当期純損失(△) |
(円) |
△238.02 |
△194.90 |
△190.55 |
△263.57 |
△184.05 |
|
潜在株式調整後1株当たり当期純利益 |
(円) |
- |
- |
- |
- |
- |
|
1株当たり配当額 (うち1株当たり中間配当額) |
(円) |
- (-) |
- (-) |
- (-) |
- (-) |
- (-) |
2【沿革】
当社は、1993年より当社創業者である遠藤仁(現杏林大学名誉教授)が杏林大学において開始した細胞膜輸送タンパク質(トランスポーター)に関するゲノム創薬研究の成果を基盤として設立されました。遠藤は、トランスポーターの研究を通じて12種類のトランスポーターを発見し、関連する特許を取得しました。中でも、1998年に分子同定された必須アミノ酸トランスポーター「LAT1」は、当社の創薬研究の中核をなす重要な創薬ターゲットとなり、これが2005年の当社設立の契機となりました。
当社の本書提出日までの変遷の概要は以下のとおりであります。
|
年月 |
概要 |
|
2005年12月 |
細胞膜のトランスポーターに特化した医薬品開発を行う会社としてジェイファーマ株式会社を東京都港区虎ノ門一丁目に設立 |
|
2006年10月 |
医薬基盤研究所 医薬品・医療機器実用化研究支援事業「高リン血症治療薬の開発」採択 |
|
2006年10月 |
東京都新宿区新宿二丁目に本社を移転 |
|
2007年 9月 |
NEDOイノベーション実用化助成事業「胃硬性がん療法の開発」採択 |
|
2007年10月 |
文部科学省分子イメージング研究プログラム「がん細胞特異膜タンパク質を標的とした新規分子プローブの開発」採択 |
|
2009年 8月 |
NEDOイノベーション推進事業「新規リン吸着剤JPH101の研究開発事業及び臨床第1相試験の実施」採択 |
|
2010年 8月 |
NEDO基礎研究から臨床研究への橋渡し促進技術開発/橋渡し促進技術開発「がん細胞に発現する必須アミノ酸トランスポーター(LAT1)を分子標的とする新規抗がん療法の研究開発」に採択 |
|
2013年 4月 |
NEDOベンチャー実用化助成事業「アミノ酸トランスポーター阻害による革新的抗がん薬の臨床開発」採択 |
|
2013年 5月 |
神奈川県横浜市鶴見区に本社を移転 |
|
2013年 7月 |
横浜市特区リーディング事業助成金「トリプルネガティブ悪性乳がんの体外診断薬キットの開発」採択 |
|
2014年 5月 |
NEDOベンチャー実用化助成事業「新規抗がん薬JPH203の臨床試験実施によるPOCの確保」採択 |
|
2014年 7月 |
横浜市特区リーディング事業助成金「トリプルネガティブ乳がん用体外診断薬の実用化」採択 |
|
2015年 1月 |
LAT1阻害剤ナンブランラト(開発コード:JPH203)の国内における第1相臨床試験を開始 |
|
2017年 7月 |
ナンブランラトの国内における第1相臨床試験を終了 |
|
2018年11月 |
ナンブランラトの国内における第2相臨床試験を開始 |
|
2019年 4月 |
大原薬品工業株式会社とナンブランラトに係るライセンス及び共同開発に関する契約締結 |
|
2022年 4月 |
ナンブランラトが米国食品医薬品局(FDA)より進行性胆道がんのオーファンドラッグ(希少性疾患医薬品)に指定 |
|
2022年12月 |
ナンブランラトの国内における第2相臨床試験を終了 |
|
2023年10月 |
中枢移行性LAT1阻害剤(開発コード:JPH034)の多発性硬化症に対する開発が、米国National Multiple Sclerosis Society (NMSS) のFast Forward商業化研究助成プログラムに採択され補助金を受領 |
|
2023年10月 |
米国での医薬品開発のための人材採用を目的としてJ-Pharma USAを設立(2025年7月に清算結了) |
|
2024年 6月 |
JPH034が国立研究開発法人日本医療研究開発機構(AMED)「創薬ベンチャーエコシステム強化事業」に採択 |
|
2024年 9月 |
ナンブランラトのがん患者に対する臨床試験に向けたInvestigational New Drug (IND) 申請が米国FDAより承認 |
|
2025年 5月 |
ナンブランラトのCMC(化学・製造・品質管理)について、米国FDAより肯定的な反応を獲得し、米国FDAが求める商業製造スケールでの品質基準を満たしていることを確認 |
|
2025年 6月 |
東京都港区浜松町へ本社移転 |
|
2025年12月 |
ナンブランラトのグローバル第3相臨床試験(胆道がん2次療法を対象)を開始 |
|
2026年 2月 |
JPH034の米国第1相試験開始に向け米国FDAによるIND安全性審査が完了 |
3【事業の内容】
(1) 事業の特徴
①概要
・企業理念と行動規範
当社は、「SLCトランスポーター※1創薬の新たな可能性を追求し、グローバルベンチャーとして世界中の人々が抱えるアンメット・メディカル・ニーズに応える革新的新薬の開発を通じ、人々が健康を維持し、希望を持ち続けることに貢献します」を企業理念として掲げております。
当社は当該理念のもと、革新的な医薬品の創出に取り組み、持続的な企業成長と社会的価値の向上を目指しております。
また、当社は、企業理念の実現のために、以下の3つを行動規範として定めております。
1.グローバルベンチャーとして挑戦する情熱
2.サイエンスの追求
3.コンプライアンスの徹底遵守
・事業構造とグローバル開発体制
当社は、グローバル市場を対象とする創薬ベンチャーとして、革新的な医薬品の研究開発を推進しております。当社の事業は研究開発を中心とした創薬事業の単一セグメントで構成されており、米国FDAをはじめ主要規制当局の承認取得を目指して臨床開発を実施しております。
図1:ジェイファーマの事業モデル
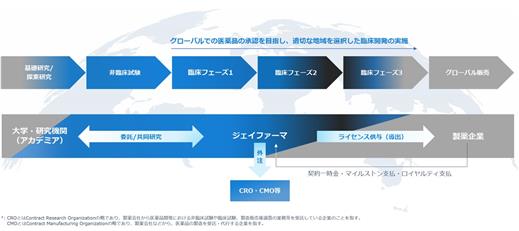
国際開発を確実に進めるため、豊富な海外経験を持つ経営陣・研究開発人材を中核に体制を整備し、欧米のCROやコンサルタントに加え、最先端のアカデミアと連携しております。主な委託・共同研究先は、米国Georgetown大学(多発性硬化症)、Mayo Clinic(特定疾患領域)、Turku PET Centre(多発性硬化症)などです。
さらに、グローバルに活躍する専門家から継続的な助言を受け、開発戦略と研究活動の高度化を図り、研究開発成果の創出につなげてまいります。
当社のアドバイザーの例
|
アドバイザー名 |
タイトル |
助言を受ける疾患領域 |
専門 |
|
古瀬純司, M.D., Ph.D. |
神奈川県立がんセンター総長 |
胆道がん |
臨床 |
|
Dr. Eric Rowinsky, M.D. |
Cancer Therapeutic Development and Regulatory Consultant |
胆道がん |
臨床・薬事 |
|
Dr. Michael Szarek, Ph.D. |
Research Professor, University of Colorado and Mount Sinai New York; Venrock |
胆道がん |
統計学・薬事 |
|
Dr. Jeff Huang, Ph.D. |
Associate Professor, Georgetown University |
多発性硬化症 |
基礎研究 |
|
Dr. Pavan Bhargava, M.D. |
Associate Professor Johns Hopkins Hospital |
多発性硬化症 |
臨床 |
|
Dr. Laura Airas, M.D., Ph.D. |
Professor of Neuroimmunology, University of Turku |
多発性硬化症 |
画像診断、臨床 |
※Dr. Eric Rowinsky, M.D. と Dr. Michael Szarek, Ph.D. は、当社との直接のアドバイザリー契約ではなく、米国の薬事・開発コンサルティング会社を通じての間接的な契約
※Dr. Laura Airas, M.D., Ph.D. は当社と Turku University Hospital との間の委託研究契約に署名する Principal Investigator
こうした体制の具体的な成果として、リード化合物「ナンブランラト」は2022年4月に米国FDAよりオーファンドラッグ指定を取得しております。また、国内第2相臨床試験のデータを基に米国FDAと協議の上、2025年12月にグローバル第3相臨床試験の開始に至りました。国内臨床データに基づき米国FDAのレビューを経てグローバル第3相臨床試験へ進む事例は多くはなく、当社としては一定の進展であると評価しております。
さらに、2剤目JPH034も、2026年2月に米国FDAによるIND安全性審査が完了し、当社が申請した臨床試験計画の実施を可能とする旨の連絡を受領いたしました。これらの進捗は、当社の開発推進力及び国際対応力を示す一要素であると考えております。
・LAT1とLAT1阻害剤
溶質輸送体(Solute Carrier; SLC)トランスポーターは、生体膜を介して多様な溶質を運ぶヒト最大級の膜タンパク質群で、これまでに400種類以上が報告されております(例:Cell. 2015, 162, 478–487)。がん・自己免疫疾患※2、代謝性疾患※3、神経変性疾患※4など幅広い領域で治療標的として提案される一方、米国FDA承認薬の標的遺伝子※5に占めるSLCトランスポーターは依然5%未満※6と未開拓領域が大きく、創薬ターゲットとして検討余地が残されている領域であると当社は認識しております。
当社創業者である遠藤仁(現杏林大学名誉教授)はトランスポーター研究の第一人者として12種類の新規トランスポーターを発見し特許化しました。当社は創業者が発見したSLCトランスポーターの一つであるL型アミノ酸トランスポーター1(LAT1)※1に注力し、その活性を抑制するLAT1阻害剤を開発しております。LAT1はがん細胞や活性化免疫細胞で高発現し、腫瘍増殖や自己免疫における免疫活性化に関与することが示されております。当社化合物はがん及び自己免疫領域で新たな治療選択肢となる可能性を示しております。
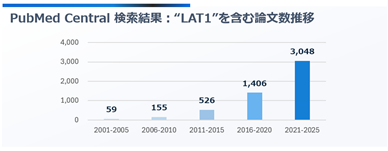
LAT1は世界中の研究者から関心を集めており(図2)、当社は創業者が2019年まで保有したLAT1遺伝子特許を背景に、国際的に早期段階から臨床開発を進めております。ヒトでの有効性や安全性について良好な結果が得られており、年1回開催されるがん治療に関する世界最高峰の学会の一つである米国臨床腫瘍学会(ASCO)では複数回の口頭発表を実施しており、国内外から共同研究又は共同開発に関する問い合わせを受けております。
図2:LAT1関連論文数推移
・ジェイファーマが考える低分子創薬の未来
当社は、LAT1阻害剤の開発において、新モダリティ※7も含めた中で、低分子化合物に特化した創薬を推進しております。低分子薬剤は経口投与可能なものが多く、細胞膜を通過して細胞内標的に作用できるという特性から、100年以上にわたり製薬の中心的な役割を担ってきました。現在も多くの疾患で中核的な選択肢の一つとして高いシェアを維持しております。
承認実績にも優位性が表れており、2017年~2022年に米国FDAが承認した新規化学物質293件のうち約62%(182件)が低分子薬※8です。さらに、AIやIn Silico技術※9の進展により創薬効率は飛躍的に向上しております。実際、AI創薬スタートアップの約45%が低分子に特化※8しており、スピードとコストで他技術を凌駕する局面が増えております。これらを踏まえ、低分子創薬は引き続き創薬手法の重要な選択肢の一つであると当社は認識しております。
この環境下で当社は、低分子の強みを最大限に活かし、LAT1阻害剤のグローバル承認を目指すことで、持続的成長と医療ニーズへの対応に資することを目指してまいります。
・First-in-ClassとBest-in-Class
First-in-Classは、新しい作用機序で未充足領域に挑み医学のフロンティアを拓く薬剤を指します。他方、Best-in-Classは、既存機序の枠内で有効性・安全性・利便性を磨き上げ、臨床性能や製剤性を最適化して最高水準の価値を実現する薬剤を指します。
当社は、未知を切り拓く開拓力(First-in-Class)と、既存技術を極める実行力(Best-in-Class)の双方を兼備することで、新しい領域において大きな事業機会を創出できると考えております。実際に、LAT1阻害剤領域で早期から臨床開発を行ってきた経験を基盤に、この開拓的立場を維持しつつ、蓄積した知見でBest-in-Class創出にも取り組み、事業基盤の一段の強化を目指します。
② LAT1阻害剤の可能性
・LAT1と固形がん
LAT1はSLCトランスポータースーパーファミリー※10に属し、がん細胞の成長・増殖に不可欠な大型中性アミノ酸の取り込みを担っております※11。
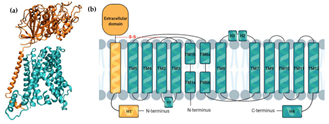
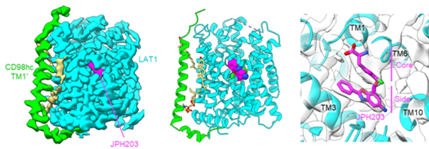
図3:LAT1の構造※12
(a) LAT1-4F2hc複合体の図(4F2hcはオレンジ、LAT1は青色)
(b) LAT1トランスポーターの膜トポロジー
がん化に伴い細胞膜上のLAT1発現が亢進し、アミノ酸取り込みが増大します。実際に、胆道がん、膵臓がん、脳腫瘍など多くの固形がんで過剰発現が確認され※13、リンパ節転移、細胞増殖、血管新生、短い生存期間と相関します※14。
腫瘍微小環境※15では、がん細胞のLAT1依存的な特定アミノ酸過剰取り込みによりその細胞外アミノ酸が枯渇し、T細胞※16の活性化・分化・機能維持に必要な代謝基材が不足するとされております。結果として、T細胞の増殖・生存・エフェクター機能※17の低下によりT細胞は本来の抗腫瘍機能を維持できず、免疫回避に関与する可能性が示唆されております。
このためLAT1阻害剤は、(1) がん細胞のアミノ酸獲得を制限し増殖を直接抑制する可能性に加え、(2) 免疫細胞の抗腫瘍機能の回復を促す可能性があると考えられております※18。
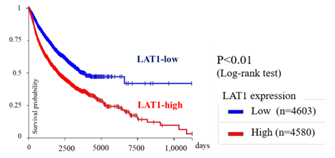
図4:全生存期間(OS)※19とLAT1遺伝子発現※20
実際、LAT1阻害剤は、細胞・動物レベルで有効性が示され(例:Cancer Sci., 2016, 107, 1499–1505; Cancer Sci., 2009, 101, 173–179; Scientific Reports, 2023, 13, Article number 13943)、当社の国内第1相/第2相臨床試験では胆道がん・大腸がんで有効性が示唆される結果が得られております※21。
・LAT1と自己免疫疾患
これまでの多くの研究から、LAT1は一部の自己免疫疾患の新規治療標的となり得ることが示されております。LAT1はmTOR経路※22を介して免疫細胞の増殖や炎症を引き起こす物質(炎症性サイトカイン)の放出を制御しており、LAT1の遺伝学的抑制やLAT1阻害剤の投与により、過剰活性化した免疫細胞からのサイトカイン産生が低減することが示されております(例:J Immunol., 2013, 191, 4080-4085; EMBO Mol Med., 2025, 17, 1631–1665)。
この知見に基づき、LAT1機能の抑制は過剰免疫反応を鎮める新たな治療アプローチとなる可能性があります※23。特に、多発性硬化症のような神経に炎症が生じる自己免疫疾患では、LAT1抑制により炎症や酸化ストレス起因の神経損傷を抑える効果が期待され、神経炎症性疾患に対する一つのアプローチとなる可能性があると考えられております※24。
・LAT1と希少疾患
LAT1は、希少疾患に対する新たな治療候補としても複数の研究で有望視されております。特定のアミノ酸関連希少疾患は、LAT1を含むSLCファミリーのアミノ酸トランスポーターの異常によって発症し、腸管・腎臓・脳・肝臓におけるアミノ酸輸送機能の障害が主な病態要因となっております※25。
米国FDAでは、Rare Disease Innovation Hubの設立、条件付き承認制度の検討、さらにはOrphan Cures Actによるインセンティブ拡充などを通じて、希少疾患治療薬の開発を後押しする施策が講じられております※26。これらの施策によって希少疾患領域での新規治療薬の研究開発は加速しており、LAT1を標的とした希少疾患を対象とする創薬も、こうした規制当局の支援を背景にアンメット・メディカル・ニーズに応える治療薬として開発を進められる可能性を有しております。
(2) 開発パイプライン
①パイプラインの概要
当社が現在臨床開発を進めている化合物は、ナンブランラト(JPH203)とJPH034の2剤です。
図5:ナンブランラトとJPH034
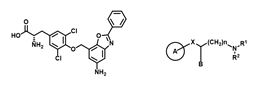
ナンブランラトは、LAT1を標的として見出した新規の低分子化合物であり、LAT1内部のアミノ酸ポケットに競合的に結合することでその活性を阻害します。正常細胞に発現するLAT2には作用せず、LAT1を選択的に阻害します※27。
図6:ナンブランラトのLAT1選択的な阻害活性※27

図7:クライオ電子顕微鏡(cryo-EM)構造解析※28
ナンブランラト(JPH203)がLAT1に競合的に結合する様子
また、特有の組織分布※29を示すことから、現在は胆道がん(2次療法※30及び1次療法)ならびに大腸がんを対象とした開発を進めております。さらに、将来的な適応拡大を見据え、希少疾患を対象とする非臨床研究にも着手しております。
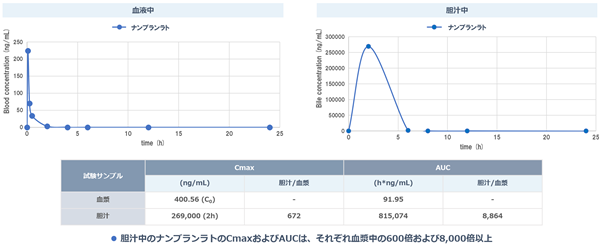
図8:サルにおけるナンブランラトの薬物濃度※31
血液中に比べ胆汁中に非常に高い濃度で分布する
(Cmax※32、AUC※33)
一方、JPH034は高い脳内移行性を有する点が特長であり、中枢神経系の自己免疫疾患である再発を伴わない2次性進行型多発性硬化症やグリオーマを対象疾患とした開発を推進しております。
加えて、当社はBest-in-Classを目指す次世代LAT1阻害剤の創薬研究にも取り組んでおり、すでに候補化合物を特定しております。これにより、ナンブランラト及びJPH034に続く新たな成長ドライバーを確立し、持続的な事業拡大を目指して取り組んでまいります。
図9:当社の開発パイプライン

②臨床開発が進む主要開発パイプライン(胆道がん、再発を伴わない2次性進行型多発性硬化症)
②-a. 胆道がん(ナンブランラト)
・胆道がんの市場規模と5年生存率
胆道がんは、日本及び欧州5か国(イギリス、フランス、ドイツ、イタリア、スペイン)でそれぞれ年間約2万人、米国で年間約1.4万人が新たに診断される疾患であります※34。早期には自覚症状が乏しいため、多くの患者は進行期に至ってから診断されるのが現状です。
進行期の胆道がんは治療選択肢が限られており、5年生存率は25%未満と、膵臓がんに次いで生存率が低いがん種です※35。こうした背景から、胆道がんはアンメット・メディカル・ニーズが非常に高い疾患であり、新たな治療法の開発が求められています。
・胆道がんとLAT1
胆道がんにおいて、LAT1の発現量を基準に患者群を比較したところ、LAT1高発現群では生存期間が有意に短いことが確認されました※36。
図10:胆道がんにおける全生存期間(OS)比較(LAT1高発現 vs. LAT1低発現)※36
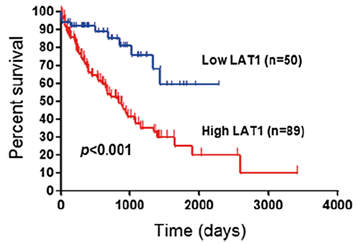
この結果は、LAT1の高発現が胆道がん患者における予後を推測する指標となり得ることを示すとともに、LAT1が新たな分子標的治療の候補として検討されている背景の一つとなっています※37。
・胆道がんの現在の治療環境
胆道がんは、日本では肝内胆管がん、肝外胆管がん、胆嚢がん、十二指腸乳頭部がんの4つに分類されますが、欧米では十二指腸乳頭部がんを除く3つが胆道がんとして扱われております。1次療法では化学療法に加え、抗PD-1抗体薬や抗PD-L1抗体薬※38が全サブタイプにおいて用いられており、現在の標準療法は化学療法と抗PD-1/PD-L1抗体薬の併用療法です。しかしながら、この治療を受けた患者のうち24か月後に生存しているのは25%以下※39にとどまっており、依然として大きなアンメット・メディカル・ニーズが存在しております※40。特に、治療開始から25週以降は抗PD-L1抗体単剤、あるいは抗PD-1抗体+ゲムシタビンによる維持療法へ移行しますが、その間の病勢進行が課題となっております。
2次療法では分子標的薬※41が用いられ、米国では3種類の承認薬があります。しかし、これらの薬剤が有効な遺伝子変異(IDH1変異、FGFR2陽性、HER2陽性)を持つのは2次療法に進む患者の約30%に限られ(図11)※42、残り約70%の患者には有効な承認薬が存在しないのが現状です(欧州・米国での状況であり、日本では2次療法で使用可能な承認薬が存在します)。
図11:胆道がんの治療選択肢
(当社作成。なお、ナンブランラトに関する記載は、承認取得又は販売開始を前提とするものではありません。)

ナンブランラトは、抗PD-1/PD-L1抗体との併用効果が動物モデルにおいて確認されており※43、1次療法において25週目以降の維持療法にアドオンすることで、標準療法と競合しない形で治療選択肢の拡充に資する可能性があります。
さらに2次療法においては、これまでの臨床試験の結果から、既存の承認薬が存在しない約70%の患者に対し、有効な治療選択肢の一つとなる可能性が示唆されております。安全性にも優れていることから、患者に最後まで寄り添える治療薬となる可能性を秘めております。
・ナンブランラトの臨床試験結果
当社は、ナンブランラトの国内第2相臨床試験を実施しました。本試験は、胆道がん2次療法以降の患者211名をスクリーニングし、105名を無作為に割り付けた大規模な二重盲検無作為化プラセボ比較試験であり、2022年に終了しました(ナンブランラト群70名(うち1名は不適格な疾患が発見されたため解析から除外され、解析対象となったのは69名)、プラセボ群35名※44が解析対象)。当試験の結果、ナンブランラトの投与により、統計学的有意差をもって腫瘍が大きくなるまでの期間を延長し、また特定の患者群において生存期間についても良好な改善効果があることが確認されました。
図12:国内第2相臨床試験のデザイン
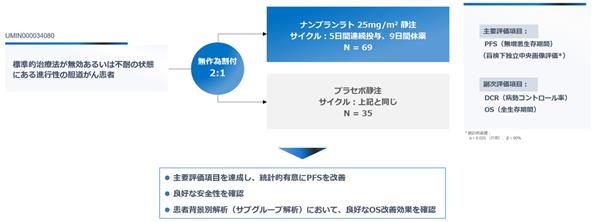
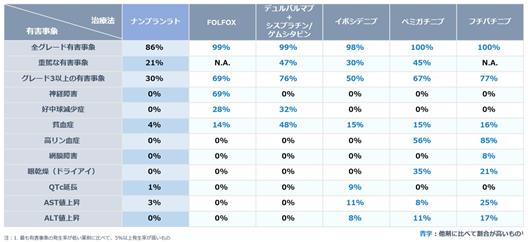
2023年1月に開催されたASCO GI 2023(米国臨床腫瘍学会・消化器がんシンポジウム)において、ナンブランラトが前治療歴のある進行性・難治性胆道がん患者に対し、無増悪生存期間(PFS)※45でプラセボ群に対して統計学的有意差を示し、主要評価項目を達成した結果が口頭発表されました(ハザード比※46=0.56、95%信頼区間:0.34–0.90、p=0.02)※47。薬物有害反応(副作用)の発生率はナンブランラト群41.4%、プラセボ群57.1%であり、グレード3以上の有害事象はナンブランラト群30.0%、プラセボ群22.9%でした。いずれの群においても投与中止・減量や死亡に至る事象は認められず、安全性が確認されました。特にグレード3以上の有害事象率は、胆道がん2次療法で使用されることのあるFOLFOX(69%)※48や1次療法の標準治療であるデュルバルマブ+シスプラチン/ゲムシタビン(76%)※49と比べても低く、ナンブランラトの良好な安全性プロファイルが示されました。この特性により、長期的治療が可能であり、現在は緩和ケアを選択している患者層への市場拡大の可能性も期待されます。
図13:胆道がん治療薬別有害事象比較※50
さらに、2023年6月のASCO Annual Meeting(米国臨床腫瘍学会年次総会)のClinical Science Symposiumでは、同試験のサブグループ解析が口頭発表されました。発表では、LAT1高発現群(ハザード比=0.44、95%信頼区間:0.23-0.85、p=0.01)、及び肝外胆管がん・胆嚢がん群(ハザード比=0.22、95%信頼区間: 0.10-0.49、p<0.001)において、統計的にさらに有意差を示したことが説明されました※51。
ASCOはがん治療において世界最高峰の学会の一つとされており、当学会における口頭発表は採択率が数%に限られることから、2023年に2回に渡りナンブランラトの臨床試験結果の口頭発表の機会が得られたことは、当社のデータが国際的に高く評価されていることを示しております。加えて、この試験結果は米国癌学会発行の学術誌「Clinical Cancer Research」(2024年9月15日号)に掲載されました。
直近では、ESMO Congress 2025において、全生存期間(OS)のサブグループ解析結果がポスター発表されました※52。本発表のサブグループ解析では、胆道がんのサブタイプのうち十二指腸乳頭部がん(欧米においては胆道がんに含まれない)を除く3つのサブタイプを対象とした解析においてハザード比=0.76(95%信頼区間:0.46–1.26)を示しました。加えて、2次療法患者群のみ(3次療法以降の患者群を除外)に限定した解析ではハザード比=0.55(95%信頼区間:0.09–3.54)、手術未実施患者群ではハザード比=0.53(95%信頼区間:0.28–1.01)と、良好なOS改善効果が確認されました。
図14:ナンブランラト第2相臨床試験 OSハザード比のサブグループ解析※52
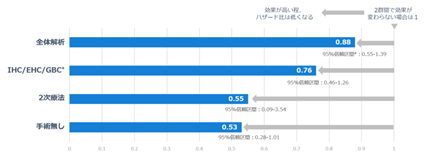
*IHC: 肝内胆管がん、EHC: 肝外胆管がん、GBC: 胆嚢がん
# 95%信頼区間: 真の値がその区間内に含まれる確率が95%であると推定される範囲
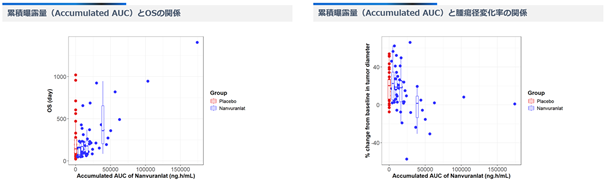
さらに、同ポスター発表では、同試験のデータを用いた曝露-反応解析も紹介されました※52。これは、薬剤の体内曝露量と有効性の関係を評価する解析であり、その結果、累積曝露量(Accumulated AUC)とOSの間に正の相関が認められました。また、累積曝露量(Accumulated AUC)が大きい程、腫瘍縮小の傾向が見られました。
図15:ナンブランラトの曝露-反応解析※52
・進行中の臨床試験: 米国FDAレビューの下でグローバル第3相臨床試験
当社は現在、米国FDAのレビュー下でグローバル第3相臨床試験を進めております。本試験には、胆道がん患者にとって「灯」となることを願い、「Beacon-BTC」と名称を付しております。
図16:グローバル第3相臨床試験(Beacon-BTC)の患者向けイメージ

本試験は、第2相臨床試験で得られた成果を踏まえ、主要評価項目を全生存期間(OS)とし、より高い効果を期待すべく対象患者の厳格なエンリッチメント※53を行います。具体的には、対象とする胆道がんサブタイプを欧米における胆道がんの定義に合わせる(十二指腸乳頭部がんを除外)とともに治療ラインを2次療法に限定し、3次療法以降の患者は対象外としております。また、Treatment Beyond Progression(TBP)を適用し、病勢進行後も治療を継続できる設計とすることで、より長期間の投与を可能としております。さらに米国では外科手術が適用される患者が少なく※54、対象患者の多くが、第2相臨床試験で効果が高かった手術未実施例となることが想定されます。第2相臨床試験の解析結果に基づくこれらの戦略により、試験の成功確率を高められると考えております。
Beacon-BTC試験は2つのパートで構成されます。
・パート Aでは、用法・用量設定を目的に、用法用量の異なる3種類のナンブランラト投与群と
最善支持療法群(Physician’s Best Choice(PBC)群※55)の4群(各30例)を比較。
・パート Bでは、パート Aで選択された用法用量のナンブランラト群と最善支持療法群の2群(各180例)を比較。
図17:グローバル第3相臨床試験(Beacon-BTC)のデザイン
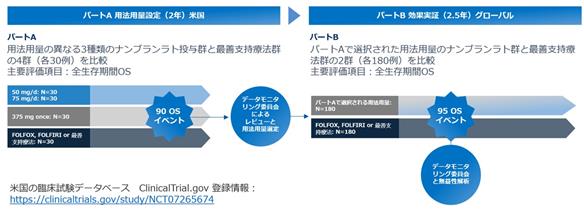
当臨床試験開始に向けて当社は、米国FDAとの緊密な対話を重ねてまいりました。2022年4月にはオーファンドラッグ指定を取得し、2024年9月にはIND申請が承認されました。さらに2025年5月にはCMC(化学・製造・品質管理)について肯定的な評価を受け、商業製造スケールでの品質基準を満たしていることを当社として確認しております。
これらの進展を経て、当社は、胆道がん治療における新たな選択肢の確立を目指して、2025年12月にBeacon-BTC試験を開始致しました。なお、試験の具体的条件及び実施体制等は、規制当局との協議や治験実施上の要請等により変更となる可能性があります。
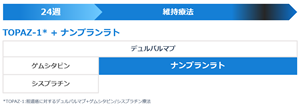
・準備中の臨床試験:ナンブランラトと免疫チェックポイント阻害剤(ICI)の併用療法
切除不能・再発胆道がんの1次治療では、ゲムシタビン+シスプラチンに免疫チェックポイント阻害剤(ICI:デュルバルマブまたはペムブロリズマブ)を併用する治療法が標準治療とされております。この治療では、24週間経過後にICI単独(ペムブロリズマブの場合はICI+ゲムシタビン)による維持療法へ移行しますが、維持療法中の病勢進行が課題となっております。
当社はこの課題に対し、ICI維持療法にナンブランラトを追加する新たな治療アプローチの開発を推進しております。本アプローチは、腫瘍微小環境における免疫抑制を解除し、ICIの効果を増強することを目的としております。前臨床モデルにおいては、ナンブランラト単剤で腫瘍免疫環境を改善する作用が確認され、さらにICIとの併用によってICI単独では得られない抗腫瘍効果が示されております※56。
胆道がんは依然として治療選択肢が限られている領域であり、ナンブランラトを1次療法に適応拡大することにより、より多くの胆道がん患者への治療貢献が可能となります。この併用療法は、プラチナ製剤※57ベースの化学療法に伴う強い副作用がないため長期投与が可能であると考えられ、既存の標準療法とも競合しないことから、本併用療法は、将来的な適応拡大の選択肢の一つとなり得る可能性があると当社は考えております。将来的には、胆道がんにとどまらず、他のICI抵抗性がん種への適応拡大も視野に入れております。
今後の計画として、今年度以降に胆道がん1次療法を対象としたICI+ナンブランラト併用の医師主導試験が開始される見込みです。本試験では、デュルバルマブ+シスプラチン/ゲムシタビンの併用療法を受け、デュルバルマブ単剤維持療法へ移行する患者を対象に、デュルバルマブ+ナンブランラト併用療法へ切り替えることで、その有効性と安全性を検証します。
図18:ICI維持療法におけるデュルバルマブとナンブランラトの併用
②-b. 再発を伴わない2次性進行型多発性硬化症(JPH034)
・多発性硬化症とは
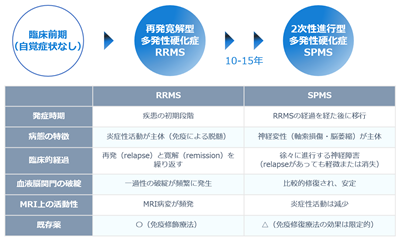
多発性硬化症は、若年成人に最も多く見られる慢性の炎症性脱髄性神経疾患であり、厚生労働省の指定難病に含まれております。診断時の平均年齢は32歳と比較的若く※58、全世界で毎年6万人以上が新たに診断され※59、現在は約290万人の患者が存在しております※60。
本疾患では、免疫反応による炎症により神経細胞の軸索※61を覆うミエリン※62が損傷(脱髄)※63し、その結果、神経信号の伝達が遅延または途絶します。そのため、感覚障害、視覚障害、運動麻痺など多様な神経症状が現れ、患者は四肢の不自由を抱え、車椅子での生活を余儀なくされることも少なくありません。
患者の約85%は再発寛解型※58で発症し、再発期と寛解期を繰り返しながら進行し、10~15年かけて2次性進行型へ移行します※64。MRI所見(MRIで測定される炎症性病変)は疾患の初期から見られ、MRI所見が生じる際は血液脳関門※65の機能破綻により末梢の免疫細胞(T細胞・B細胞※66)が脳内へ侵入し、脱髄と不可逆的な組織損傷を引き起こします※67※64。
一方で、2次性進行型に移行すると、MRI所見の頻度は減少し、MRI所見がない間は末梢免疫細胞の浸潤は見られなくなるものの、脳内では「くすぶり炎症(smoldering inflammation)」が持続し、病状が進行します※68。この段階では、末梢のT細胞やB細胞を標的とする既存薬の効果は乏しく※69、再発を伴わない2次性進行型に対する治療選択肢は依然として限られているのが現状です。
図19:多発性硬化症の臨床経過
・くすぶり炎症とミクログリアとLAT1
2次性進行型で中心的な病態とされる「くすぶり炎症(smoldering inflammation)」は、脳内に常在する免疫細胞であるミクログリア※70が引き起こすと考えられております※68。そのため、この病態に対処するには、従来のように末梢免疫細胞を標的とするのではなく、薬剤が脳内に移行してミクログリアの活性を直接抑制する治療アプローチが求められていると当社は認識しております。
近年、このアプローチに基づき開発された代表例が、中枢移行性の高いBTK阻害剤※71トレブルチニブです。開発元であるサノフィ社は、再発を伴わない2次性進行型多発性硬化症を対象とする第3相臨床試験を終了しNDA(新薬承認申請)を米国FDAに提出したものの、Complete Response Letter(CRL)を受領した旨を公表しており、現在引き続きFDAと協議し前進の道筋を検討する方針を示しています※72。
一方で、ミクログリアの活性化にはLAT1が必須アミノ酸輸送を介して関与することが知られております※73。この知見を踏まえると、中枢移行性を有するLAT1阻害剤によりミクログリアを標的とし、その活性を抑制することで、2次性進行型多発性硬化症に対する新たな治療法となる可能性が示唆されます。
図20:既存薬 vs. 脳移行型新薬候補の比較
(当社作成。なお、脳移行型新薬候補に関する記載は前臨床段階を含む研究開発中の情報であり、
将来の臨床成績又は承認取得を示唆するものではありません。)

・中枢移行性LAT1阻害剤:JPH034
当社が開発中のJPH034は、高い脳内移行性を有するLAT1阻害剤です。本剤は脳内へ移行し、ミクログリアを標的とすることで、既存薬が限定的である「再発を伴わない2次性進行型多発性硬化症」に対する新たな治療アプローチとなり得る可能性を持っております※24※74。
研究開発パートナーである米国Georgetown大学が実施したマウスモデル試験では、JPH034が脳内病変部のミクログリアを再プログラムし、再生促進型の状態へ導くことにより、中枢神経系の局所炎症を抑制することが確認されました※75。この作用機序により、既存治療薬とは異なるアプローチの治療戦略を検討しております。
さらに、JPH034は良好な経口バイオアベイラビリティ※76とPKプロファイル※77を有しており、長期治療を必要とする多発性硬化症患者にとって、1日1回の経口投与が可能となる潜在的な利便性を有すると当社は考えております。
・開発状況と準備中の臨床試験
当社が開発を進めるJPH034(再発を伴わない2次性進行型多発性硬化症を対象)は、競争が極めて厳しく評価水準も高いことで知られる米国 National Multiple Sclerosis Society(NMSS)のFast Forward Research Grantに選出され、60万米ドルの補助金交付を受けております。さらに、国立研究開発法人日本医療研究開発機構(AMED)の創薬ベンチャーエコシステムにも採択され、IPOまで利用可能な最大20億円規模の補助金を確保しております。
知財面では、当社は米国Georgetown大学が保有するLAT1阻害剤の中枢性炎症性疾患(多発性硬化症を含む)に関する用途特許の独占的通常実施権をグローバルに取得し、開発・商業化における権利保護の強化を目指しております。
研究開発面では、米国Georgetown大学によるマウスモデル試験により、LAT1阻害剤による臨床スコアの改善、免疫調整・神経保護作用、視覚誘発電位(VEP)遅延の改善などを確認しました※24。また、Turku PET Centreとの委託臨床研究を進めており、中枢神経系の炎症要因の一つであるミクログリアの活性化とLAT1の発現が脱髄病巣レベルで共存することを確認しました※24。
また、AMED補助金を活用して第1相試験用治験薬の製造完了後、2026年2月に米国FDAによるIND安全性審査が完了し、当社が申請した臨床試験計画の実施を可能とする旨の連絡を受領いたしました。本第1相臨床試験につきましては、2025年度第4四半期以降の試験開始を予定しております。
・市場規模
2次性進行型多発性硬化症の市場規模は、2024年で約56億米ドル、2033年には約98億米ドルに達すると推計されております※78。その成長要因としては、再発寛解型からの移行による患者数の増加、診断技術の進歩による診断率向上、さらに効果の高い新薬の上市が挙げられます※78。
このように大きな市場規模を背景に、多発性硬化症領域ではグローバル大手製薬企業が積極的にライセンス契約を締結してきた実績があります。例えば、2023年4月にContineum Therapeutics社がJanssen Pharmaceutica社に導出したPIPE-307は、第1相臨床試験を完了し第2相試験開始を控えた段階の化合物でありながら、契約一時金5,000万米ドル、マイルストン収入最大10億米ドル、ロイヤルティ最大10%台後半という大規模な契約条件となっております※79。先に述べたトレブルチニブと同様にPIPE-307も高い中枢移行性を有しており、これらの事例は、当社が開発を進める中枢移行型LAT1阻害剤JPH034についても、適切な開発進展を経ることで将来的なライセンス交渉の参考となると考えられます。
図21:多発性硬化症(MS)治療薬のライセンス契約の事例※80

③その他の開発パイプライン
・その他の臨床開発
当社は現在、ナンブランラトの胆道がん2次療法(単剤療法)及び1次療法(ICIとの併用療法)、JPH034の再発を伴わない2次性進行型多発性硬化症を重点的に開発しております。これに加えて、KRAS変異大腸がん※81(ナンブランラト)及びグリオーマ(JPH034)についても開発を進めてまいります。
ナンブランラトは、非臨床及び臨床データに基づき、大腸がんに対する適応拡大の可能性が示されております。特に、転移性大腸がんの約40%を占める※82KRAS変異型では既存薬の効果が限定的である※83一方、LAT1の高発現が患者予後不良と強く関連する臨床データが報告されております※84。また、ナンブランラトがKRAS変異大腸がん細胞株において有意な増殖抑制効果を示す非臨床試験結果も公表されております※85。さらに、複数の固形がんを対象とした第1相臨床試験では、大腸がん患者6例中2例で「安定(SD)」が確認されており※86、今後の臨床開発に向け、一定の示唆が得られております。このように当社としてもKRAS変異大腸がんに対するナンブランラトの開発可能性を見出していたところ、米国の大学より共同研究開発の提案を受け、現在は同大学にて医師主導臨床試験の開始に向けた補助金申請をしております。
一方、グリオーマについては、米国の大規模研究機関からの提案を受け、グリオーマにおけるLAT1関与の複数の報告※87及びJPH034の高い脳内移行性を根拠に開発に着手しました。現在は、当該研究機関に対して当社開発品を提供し、前臨床段階での検討が進行中です。
大腸がんとグリオーマの市場規模※88
|
大腸がん全体 |
199.5億米ドル(2034年予測) |
|
グリオーマ全体 |
75.1億米ドル(2031年予測) |
当社は、胆道がん2次・1次療法及び再発を伴わない2次性進行型多発性硬化症を最優先とし、それ以外の臨床開発については資金状況やコストを踏まえ、適切なリスク管理のもとで段階的に推進してまいります。
・希少疾患を対象とする非臨床試験
一部のアミノ酸代謝性希少疾患は、LAT1を含むSLCファミリーのアミノ酸トランスポーター異常によって発症し、腸管・腎臓・肝臓におけるアミノ酸輸送機能の障害が主な病態要因とされております※25。
当社は、ナンブランラトが肝臓・胆管・大腸などに高濃度で分布する特有の組織分布に着目し、ある希少疾患の動物モデルにおいて有効性を示唆する結果を得ました※89。この成果を踏まえ、当該適応症に関する用途特許を申請中であり、ナンブランラトの適応拡大に向けた新たな可能性を追求しております。
・Best-in-Class の次世代LAT1阻害剤の創薬研究
当社は、高度な専門知識と経験を備えた人材を採用することで、創薬研究チームを強化し、Best-in-Classを目指す次世代LAT1阻害剤の研究開発を本格的に進めております。
既に、ナンブランラトと同等程度又はそれ以上の特性を有する可能性のある候補化合物を特定しており、現在はその構造最適化を進めるとともに、非臨床評価を進めております。当社はこの取り組みを通じて、次世代化合物の創出を推進しております。
(3) 事業系統図
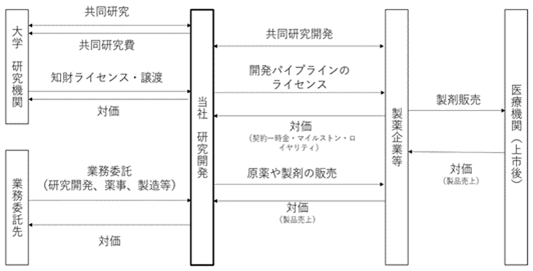
<製薬企業等から受領する対価の体系>
|
契約一時金 |
ライセンス契約の締結時に、契約に基づき当社が収入として得るもの。 |
|
マイルストン収入 |
開発又は販売に関して予め定義するマイルストンを達成した際に、契約で定められた金額を当社が収入として得るもの。 |
|
ロイヤルティ収入 |
当社がライセンスした製品について、当該製品が承認を受け販売が開始された後、その売上高に対して契約で定める一定の割合を乗じて算出される金額を収入として得るもの。 |
(注記)
|
番号 |
解説または引用 |
|
※1 |
SLCトランスポーター:細胞のまわりは「細胞膜」という薄い膜で覆われており、物質が自由に出入りすることができません。しかし細胞はブドウ糖やアミノ酸、イオンなど、体にとって重要な物質を細胞内に取り込む必要があります。そこで必要な物質の細胞内への取り込みの機能を果たしているのがSLC (Solute Carrier) トランスポーターです。SLCトランスポーターは細胞膜のドアの役割を果たし、特定の物質だけを細胞の中に入れたり、外に出したりします。 「Solute:溶質」とは、水に溶けている物質のことです。たとえば、ブドウ糖、アミノ酸、イオンなどが溶質にあたります。SLCトランスポーターは、こうした溶質を適切に運びます。 SLCトランスポーターは、ヒトの体では約400種類あることが知られています。これらは種類ごとに適切な細胞に発現し、特定の溶質を輸送することで、細胞の適切な機能に貢献しています。 LAT1:LAT1は、当社創業者である遠藤仁(現杏林大学名誉教授)が発見したSLCトランスポーターで、アミノ酸を細胞内に取り込みます。健康な体では、特定の場所の細胞にしか発現していません。しかし、通常の細胞ががん化し、大量のアミノ酸を必要とすると、このLAT1が細胞表面に過剰に現れ、アミノ酸をがん細胞内に取り込むことで、がん細胞の増殖に寄与します。LAT1の発現量はがん患者の予後にも影響があることが分かっており、がんに対する新しい治療標的として注目されています。 |
|
※2 |
自己免疫疾患:細菌やウイルス、腫瘍などの自己と異なる異物を排除するための役割を持つ免疫系が、本来の働きをせずに自分自身の正常な細胞や組織に対してまで過剰に反応し攻撃を加えてしまうことで異常を来す疾患の総称です。関節リウマチ、全身性エリテマトーデス、シェーグレン症候群などに代表される膠原病、多発性筋炎、多発性硬化症等の全身性自己免疫疾患と、自己免疫性溶血性貧血、潰瘍性大腸炎、バセドウ病、橋本病等の臓器特異的自己免疫性疾患の2種類があります。 |
|
※3 |
代謝性疾患:生活習慣病として知られる糖尿病、脂質異常症、脂肪肝、高尿酸結晶(痛風)などが代表的な疾患です。 |
|
※4 |
神経変性疾患:何らかの原因により脳や脊髄の神経細胞が徐々に失われ、物忘れが多くなったり(認知症)、手足がうまく動かせなくなったり(運動障害)する病気です。アルツハイマー病やパーキンソン病、筋萎縮性側索硬化症、ポリグルタミン病などがあります。 |
|
※5 |
標的遺伝子:特定の疾患の発症に関わる遺伝子やタンパク質を特定し、それらを治療薬の作用標的(ターゲット)として位置づけたものを指します。 |
|
※6 |
2017年時点、米国FDA承認薬の標的遺伝子667個の内訳データに基づきます。13のSLCトランスポーターが米国FDA承認薬の標的になっております。 |
|
※7 |
モダリティ:創薬研究におけるモダリティ(modality)とは、治療に用いる薬の種類や作用様式を分類する概念を指します。代表的なものとして、化学合成された低分子医薬品、標的に高い特異性で結合する抗体医薬品、mRNAやsiRNAなどによる核酸医薬、タンパク質と低分子の中間的特徴を持つペプチド医薬、さらにCAR-T細胞や遺伝子編集を活用した細胞・遺伝子治療などが挙げられます。 |
|
※8 |
L. Howes, Chemical & Engineering News. 2023, Volume 101, Issue 36. "Why small-molecule drug discovery is having a moment". (https://cen.acs.org/pharmaceuticals/drug-discovery/small-molecule-drug-discovery-having/101/i36 最終アクセス日 2025年10月28日) |
|
※9 |
In Silico技術:コンピュータを用いたシミュレーションや解析によって、薬剤候補の探索や最適化を行う技術の総称です。分子ドッキングや構造ベース創薬、機械学習による予測モデルなどを用いて、実験前に標的分子との相互作用や薬効・副作用の可能性を評価できる点が特徴です。 |
|
※10 |
SLCトランスポータースーパーファミリー:ヒトには約400種類のSLCトランスポーターが存在し、これらはまとめてSLCトランスポータースーパーファミリーに分類されます。LAT1は、その中の一つであるLATファミリーに含まれますが、LATファミリー以外にも、輸送する溶質や構造、機能の異なる多様なSLCトランスポーターのファミリーが存在します。このような高い多様性をもつことから、SLCは単なるファミリーではなく、より大きな括りとして「スーパーファミリー」と呼ばれます。 |
|
※11 |
Y. Zhao et al., "The role of L-type amino acid transporter 1 in human tumors" Intractable Rare Dis Res., 2015, 4, 165–169. |
|
※12 |
C. Lopes et al., “ASCT2 and LAT1 Contribution to the Hallmarks of Cancer: From a Molecular Perspective to Clinical Translation” Cancers (Basel), 2021, 13, 203. Licensed under CC BY 4.0 (https://creativecommons.org/licenses/by/4.0/). |
|
※13 |
S.Yothaisong et al., "Increase in L-type amino acid transporter 1 expression during cholangiocarcinogenesis caused by liver fluke infection and its prognostic significance" Parasitol Int., 2017, 66, 471-478.; K. Kaira et al., “Prognostic significance of L-type amino-acid transporter 1 expression in surgically resected pancreatic cancer” Br J Cancer., 2012, 107, 632-638.; N. Yanagisawa et al., “High expression of L-type amino acid transporter 1 (LAT1) predicts poor prognosis in pancreatic ductal adenocarcinomas” J Clin Pathol., 2012, 65, 1019-1023.; Z. Haining et al., “Relation of LAT1/4F2hc expression with pathological grade, proliferation and angiogenesis in human gliomas” BMC Clin Pathol., 2012, 12, Article number 4.; H. Nawashiro et al., "L-type amino acid transporter 1 as a potential molecular target in human astrocytic tumors" Int J Cancer., 2006, 119, 484-492. |
|
※14 |
J. Zhang et al., "Review of the Correlation of LAT1 With Diseases: Mechanism and Treatment" Front Chem., 2020, 8, 564809. |
|
※15 |
腫瘍微小環境:腫瘍微小環境(tumor microenvironment, TME)とは、腫瘍細胞の周囲に存在する血管、免疫細胞、線維芽細胞、細胞外基質、サイトカインなどを含む環境のことを指します。これらは腫瘍の増殖や転移、さらには薬剤感受性に大きな影響を与えるため、がん研究や治療標的として重要視されております。 |
|
※16 |
T細胞:T細胞は免疫細胞の一つでありリンパ球の60~80%を占め、自らが働き、体を防御するとともに、一度侵入してきた病原体を記憶し、それに基づいてすばやく対応し、排除する働きをもっております。 |
|
※17 |
エフェクター機能:エフェクター機能(effector function)とは、T細胞などの免疫細胞が、がん細胞やウイルス感染細胞に対して実際に攻撃・排除を行う機能を指します。エフェクター機能は免疫系による抗腫瘍活性の中核を担う重要な機能であり、その低下は免疫回避の主要因となります。 |
|
※18 |
M. Nachef et al., "Targeting SLC1A5 and SLC3A2/ SLC7A5 as a Potential Strategy to Strengthen Anti-Tumor Immunity in the Tumor Microenvironment" Front. Immunol., 2021, 624324.; Y. Zhao et al., "Targeting LAT1 with JPH203 to reduce TNBC proliferation and reshape suppressive immune microenvironment by blocking essential amino acid uptake" Amino Acids. 2025, 57, 27. |
|
※19 |
全生存期間(OS):治療開始から死亡(あらゆる原因による死亡を含む)までの期間を指します。英語ではOverall Survivalといいます。治療の効果を直接的に反映する指標であり、がん領域などで最も重要な評価項目のひとつとされております。 |
|
※20 |
R. Otani et al., “The Anti-Tumor Effect of the Newly Developed LAT1 Inhibitor JPH203 in Colorectal Carcinoma, According to a Comprehensive Analysis” Cancers 2023, 15, 1383. Licensed under CC BY 4.0 (https://creativecommons.org/licenses/by/4.0/). |
|
※21 |
N. Okano et al., "First-in-human phase I study of JPH203, an L-type amino acid transporter 1 inhibitor, in patients with advanced solid tumors" Invest New Drugs., 2020, 38, 1495-1506.; J. Furuse et al., "A Phase II Placebo-Controlled Study of the Effect and Safety of Nanvuranlat in Patients with Advanced Biliary Tract Cancers Previously Treated by Systemic Chemotherapy “Clin Cancer Res., 2024, 30, 3990–3995. |
|
※22 |
mTOR経路:細胞の成長や代謝、増殖、そして生存を制御する中心的なシグナル伝達経路のことを表します。栄養(アミノ酸やグルコース)、エネルギー状態、成長因子などの刺激を感知し、タンパク質合成や自食作用(オートファジー)の調節を通じて、細胞機能を最適化します。この経路の異常は、がん、糖尿病、神経疾患など多くの病態と関連しており、mTOR阻害薬(例:ラパマイシンやその誘導体)は臨床的にも重要な治療薬となっております。 |
|
※23 |
B.R. Yoon et al., "Role of SLC7A5 in Metabolic Reprogramming of Human Monocyte/Macrophage Immune Responses" Front. Immunol., 2018, 09, 00053.; D. Cibrian et al., “Targeting L-type amino acid transporter 1 in innate and adaptive T cells efficiently controls skin inflammation” J Allergy Clin Immunol., 2020, 145, 199-214.e11. |
|
※24 |
当社と Georgetown大学, Turku大学との共同・委託研究結果に基づく社内レポート |
|
※25 |
R. Yahyaoui and J. Pérez-Frías. "Amino Acid Transport Defects in Human Inherited Metabolic Disorders" Int J Mol Sci., 2019, 21, 119.; M. Palacín et al., "Amino Acid Transport Defects" Physician’s Guide to the Diagnosis, Treatment, and Follow-Up of Inherited Metabolic Diseases. 2022, 291-312.; A.M. Sokolov et al., "The amino acid transporter Slc7a5 regulates the mTOR pathway and is required for granule cell development" Hum Mol Genet., 2020, 29, 3003–3013. |
|
※26 |
U.S. Food and Drug Administration (FDA) (https://www.fda.gov/about-fda/center-drug-evaluation-and-research-cder/accelerating-rare-disease-cures-arc-program 最終アクセス日 2025年10月28日) |
|
※27 |
M.F. Wempe et al., "Developing selective L-Amino Acid Transport 1 (LAT1) inhibitors: A Structure-Activity Relationship overview" Medical Research Archives, 2019, 7, issue 12. |
|
※28 |
Adapted from Y. Lee, et al., “Structural basis of anticancer drug recognition and amino acid transport by LAT1.” Nature Communications, 2025, 16:1635. Licensed under CC BY 4.0 (https://creativecommons.org/licenses/by/4.0/). |
|
※29 |
組織分布:組織分布とは、投与された薬剤が体内のどの臓器・腫瘍にどの程度集積するかを示す指標であり、薬剤の“治療標的への到達精度”を評価する重要な概念です。 治療効果の発現や副作用リスクを左右する要素であるため、腫瘍など“狙った組織へ選択的に分布できているか”は創薬の競争力を判断する上で重要な評価ポイントとなります。 |
|
※30 |
2次療法:治療が効かなくなった場合や、治療を続けるのが困難な副作用が現れた場合は、別の治療に切り替えて薬物療法を続けていきます。 このとき、最初に行う治療を1次療法、その後に順次行う治療を2次療法、3次療法と呼びます。 |
|
※31 |
社内非公開レポート |
|
※32 |
Cmax:薬を投与した後に血中に到達する濃度の中で最も高い「最高血中濃度」を指します。これは薬の有効性や安全性と関連があり、同じ薬でも製剤が異なればCmaxが異なる場合があり、製剤の比較や生物学的同等性(BE)の評価に用いられる薬物動態の重要な指標です。 |
|
※33 |
AUC:Area Under the Curve(血中濃度時間曲線下面積)の略で、血漿中の薬物濃度が時間とともに変化するグラフにおいて、時間軸と薬物濃度曲線で囲まれた面積のことです。この面積が大きいほど、体内に取り込まれた薬物の総量が多いことを示し、薬剤の生体利用率(バイオアベイラビリティ)を比較する際の重要な指標となります。 |
|
※34 |
米国:Bureau, United States Census. 2023. QuickFacts United States. [Online] July 1, 2023、Epidemiologic patterns of biliary tract cancer in the United States: 2001–2015. Jill Koshiol+4. 2022. 2022, National Library of Medicineを元に当社試算。 EU4*+UK:What is bile duct cancer?, Cancer Research UK、Gallbladder cancer statistics, Cancer Research UK、NCIN Data Briefing, Incidence and survival of ampulla of Vater and duodenal cancers, National Cancer Intelligence Network、The World Bank, DataBank, Population estimates and projections 、Liver cancer, Label_Logo Zentrum für Krebsregisterdaten、Cancer in gallbladder and biliary tract, Label_Logo Zentrum für Krebsregisterdaten、D. Walter et al., "The Diagnosis and Treatment of Ampullary Carcinoma" Dtsch Arztebl Int., 2023, 120, 729-735.、Population factsheets, Cancer Today, International Agency for Research on Cancer、The World Bank, DataBank, Population estimates and projections を元に当社試算。(*EU4: フランス・ドイツ・イタリア・スペイン) 日本:Cancer Statistics 2016-2019. Cancer Information Service, National Cancer Center, Japan、S. Ishihara et al., “Biliary tract cancer registry in Japan from 2008 to 2013” J Hepatobiliary Pancreat Sci., 2016, 23, 149-157を元に当社試算 |
|
※35 |
公益財団法人がん研究振興財団 がんの統計2023 (https://ganjoho.jp/public/qa_links/report/statistics/2023_jp.html 最終アクセス日 2025年10月28日) |
|
※36 |
K. Kaira, et al. "Clinical significance of L-type amino acid transporter 1 expression as a prognostic marker and potential of new targeting therapy in biliary tract cancer" BMC Cancer, 2013, 13, 482. Licensed under CC BY 2.0 (https://creativecommons.org/licenses/by/2.0/). |
|
※37 |
N. Yanagisawa et al., “High expression of L-type amino acid transporter 1 as a prognostic marker in bile duct adenocarcinomas” Cancer Med., 2014, 3, 1246-1255.; S.Yothaisong et al., "Increase in L-type amino acid transporter 1 expression during cholangiocarcinogenesis caused by liver fluke infection and its prognostic significance" Parasitol Int., 2017, 66, 471-478. |
|
※38 |
抗PD-1抗体薬:PD-1(Programmed cell Death 1)は、T細胞などの免疫細胞の表面に発現する免疫チェックポイント分子であり、がん細胞や樹状細胞などに発現するPD-L1と結合することで、免疫細胞の働きを抑制します。抗PD-1抗体によりPD-1がPD-L1と結合しなくなることで、免疫細胞の抑制が解除され、本来の働きを取り戻し、がん細胞を攻撃するようになると考えられております。 抗PD-L1抗体薬:PD-L1(Programmed cell Death Ligand 1)は、樹状細胞やがん細胞の表面に発現する免疫チェックポイント分子であり、免疫細胞上に発現するPD-1と結合することで、免疫細胞の働きを抑制します。抗PD-L1抗体によりPD-L1がPD-1と結合しなくなることで、免疫細胞が本来の働きを取り戻し、がん細胞を攻撃するようになると考えられております。 |
|
※39 |
D.-Y. Oh et al., "A phase 3 randomized, double-blind, placebo-controlled study of durvalumab in combination with gemcitabine plus cisplatin (GemCis) in patients (pts) with advanced biliary tract cancer (BTC): TOPAZ-1" J Clin Oncol., 2022, 40, Number 4_suppl. |
|
※40 |
P.V. Cuesta et al., "Exploring the Promise of Second-Line Chemotherapy in Biliary Tract Tumours: A Glimpse into Novel Treatment Approaches" Cancers 2023, 15, 5543.; Z. Li et al., "Recent advances in systemic therapy for advanced biliary tract cancer: A systematic review and meta-analysis using reconstructed RCT survival data" JHEP Reports. 2025, 7, 101290. |
|
※41 |
分子標的薬:がん細胞などの特定の細胞だけを攻撃する治療薬のことです。 主にがん領域で使われており、標的とする細胞だけで作られる異常なタンパク質(分子)などの目印を見つけて、標的の細胞を攻撃します。正常な細胞へのダメージが少なく、副作用が抑えられると考えられております。 |
|
※42 |
各遺伝子変異陽性の患者のみ (NCCN Guideline BTC 2025, COMPILE Claim Data Dec 2023) |
|
※43 |
R. Huang et al., "Targeting glutamine metabolic reprogramming of SLC7A5 enhances the efficacy of anti-PD-1 in triple-negative breast cancer" Front Immunol., 2023, 14, 1251643. |
|
※44 |
プラセボ:見た目や味は薬と同じで薬効成分を含まないものを示す言葉で、偽薬とも呼ばれます。本来は薬としての効果をもたないプラセボを服用し得られる効果を差し引いて、本当の意味での薬の有効性を科学的に明らかにするために、臨床試験で使用されます。 |
|
※45 |
無増悪生存期間(PFS):治療中(治療後)にがんが進行せず安定した状態である期間のことです。英語ではProgression-Free Survivalといいます。 |
|
※46 |
ハザード比:統計学上の用語で、相対的な危険度を客観的に比較する方法です。臨床試験で比較検討した薬剤Aと薬剤Bにおいて、ハザード比が1であれば2つの治療法に差はなく、ハザード比が1より小さい場合には薬剤Aの方が有効と判定され、その数値が小さいほど有効であるとされます。信頼区間とp値は算出された統計データの信頼性を示す数値です。 |
|
※47 |
米国臨床腫瘍学会消化器がんシンポジウム(Gastrointestinal Cancers Symposium : ASCO GI 2023) 口頭発表: Nanvuranlat, an L-type amino acid transporter (LAT1) inhibitor for patients with pretreated advanced refractory biliary tract cancer (BTC): Primary endpoint results of a randomized, double-blind, placebo-controlled phase 2 study. (https://ascopubs.org/doi/10.1200/JCO.2023.41.4_suppl.494) |
|
※48 |
A. Lamarca et al., “Second line FOLFOX chemotherapy versus active symptom control for advanced biliary tract cancer (ABC-06): a phase 3, open-label, randomized, controlled trial” Lancet Oncol., 2021, 22, 690–701. |
|
※49 |
D.-Y. Oh et al., “Durvalumab plus Gemcitabine and Cisplatin in Advanced Biliary Tract Cancer” NEJM Evid., 2022, 1 (8). |
|
※50 |
Nanvuranlat: Phase 2 CSR FOLFOX: ※48 TOPAZ1(ゲムシタビン/シスプラチンとデュルバルマブ併用療法): ※49 Tibsovo: A.X. Zhu et al., “Final Overall Survival Efficacy Results of Ivosidenib for Patients With Advanced Cholangiocarcinoma With IDH1 Mutation. The Phase 3 Randomized Clinical ClarIDHy Trial” JAMA Oncol., 2021, 7, 1669-1677. Pemazyre: G.K. Abou-Alfa et al., “Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: a multicenter, open-label, phase 2 study” Lancet Oncol., 2020, 21, 671-684. Lytgobi: L. Goyal et al., “Futibatinib for FGFR2-Rearranged Intrahepatic Cholangiocarcinoma” N Engl J Med., 2023, 388, 228-239. |
|
※51 |
米国臨床腫瘍学会年次総会(2023 ASCO Annual meeting) Clinical Science Symposium 口頭発表: Clinical Science Symposium : Subgroup analysis of double-blind, placebo-controlled Ph. 2 study of nanvuranlat in treatment of pre-treated, advanced, refractory biliary tract cancer (BTC): Patients with high LAT1 expression and response to nanvuranlat. (https://ascopubs.org/doi/10.1200/JCO.2023.41.16_suppl.4011) |
|
※52 |
2025年欧州臨床腫瘍学会(ESMO)年次総会 (ESMO Congress 2025) ポスター発表: 98P - Subgroup analysis of a Ph.2 study of nanvuranlat in pre-treated, advanced, refractory biliary tract cancer patients (BTC) support an enriched patient population for a planned Ph.3 study |
|
※53 |
エンリッチメント:試験の精度や有効性を高めるために、あらかじめ特定の特徴を持つ被験者を選択して組み入れる手法を指します。 |
|
※54 |
COMPILE Claim Data Dec 2023 |
|
※55 |
Physician’s Best Choice:治験に参加する医師が、その時点で承認されている標準治療や慣習的に用いられている治療の中から、患者ごとに最も適切と判断した治療法を選択することを指します。本臨床試験の場合、FOLFOX or FOLFIRI or ベストサポーティブケアから医師が選択することになります。 |
|
※56 |
社内非公開レポート、及び※43 |
|
※57 |
プラチナ製剤:プラチナ製剤は、DNAに結合して複製や修復を阻害し、がん細胞の増殖を抑える抗がん剤です。 |
|
※58 |
Atlas of MS 3rd edition, MS International federation, September 2020 (chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://www.msif.org/wp-content/uploads/2020/10/Atlas-3rd-Edition-Epidemiology-report-EN-updated-30-9-20.pdf) |
|
※59 |
G. Khan and M.J. Hashim, "Epidemiology of Multiple Sclerosis: Global, Regional, National and Sub-National-Level Estimates and Future Projections" J Epidemiol Glob Health., 2025, 15, 21. |
|
※60 |
MS Fact Sheet, MS International federation (https://atlasofms.org/map/united-states-of-america/epidemiology/number-of-people-with-ms 最終アクセス日 2025年9月9日) |
|
※61 |
軸索:神経細胞から他の細胞へ電気信号を伝える細長い突起です。 |
|
※62 |
ミエリン:中枢及び末梢神経系の軸索を取り巻く脂質に富んだ鞘(ミエリン鞘)のことです。電気的な絶縁体として働き、神経インパルスの伝導速度を飛躍的に高める役割を担っております。ミエリンは神経機能の維持に不可欠であり、これが損なわれると神経伝達が障害されます。 |
|
※63 |
脱髄:脳や脊髄、視神経といった神経系の神経線維を包む「さや」(髄鞘)の部分に起こる炎症により髄鞘が消失し、さまざまな神経症状が生じます。 |
|
※64 |
R.J. Fox and J.A. Cohen "Multiple sclerosis: The importance of early recognition and treatment" Cleve Clin J Med,, 2001, 68, 157–170. |
|
※65 |
血液脳関門:血液中の物質が脳へ移行するのを選択的に制御する防御機構です。 |
|
※66 |
B細胞:B細胞は免疫細胞の一つでありリンパ球の約20-40%を占め、体内に侵入した病原体を排除するために必要な抗体を作り出し、体液性免疫に関わります。 |
|
※67 |
M.H. Sheikh et al., "Immuno-metabolic impact of the multiple sclerosis patients’ sera on endothelial cells of the blood-brain barrier"J Neuroinflamm., 2020, 17, 153. |
|
※68 |
S. Bittner et al., "Implications of immunometabolism for smouldering MS pathology and therapy" Nat Revs Neurol., 2023, 19, 477–488. |
|
※69 |
J. Correale et al., "Progressive multiple sclerosis: from pathogenic mechanisms to treatment" Brain. 2017, 140, 3.; D. Ontaneda et al., "Progressive multiple sclerosis: prospects for disease therapy, repair, and restoration of function" Lancet. 2017, 389(10076), 1357-1366. |
|
※70 |
ミクログリア:ミクログリアは神経回路の活動の恒常性を担うグリア細胞の一種であり、中枢の免疫担当細胞として知られ、中枢神経系に存在する常在性マクロファージとも呼ばれます。 |
|
※71 |
BTK阻害剤:B細胞受容体シグナル伝達に関与するブルトン型チロシンキナーゼ(BTK)の働きを阻害し、異常なB細胞の増殖や活性化を抑制する薬剤です。 |
|
※72 |
Sanofi Press Release(URL: https://www.sanofi.com/en/media-room/press-releases/2025/2025-12-24-06-00-00-3210238 最終アクセス日 2025年12月25日) |
|
※73 |
N. Cappoli et al., "LAT1, a novel pharmacological target for the treatment of glioblastoma" Biochem Pharmacol., 2022, 201, 115103.; T. Ishimoto et al., "Inhibition of amino acid transporter suppresses activation of microglial cell lines" The 97th Annual Meeting of the Japanese Pharmacological Society, Session 2-B-P-002, Kobe, 2023. DOI: 10.1254/jpssuppl.97.0_2-B-P-002. |
|
※74 |
J. Krämer et al., "Bruton tyrosine kinase inhibitors for multiple sclerosis" Nat Rev Neurol., 2023, 19, 289–304. |
|
※75 |
当社とGeorgetown大学との共同・委託研究結果に基づく社内レポート |
|
※76 |
バイオアベイラビリティ:投与された薬が全身循環に到達し、有効に利用可能となる割合を指します。特に経口投与では、消化管吸収や初回通過効果の影響を受けるため、この値が重要な薬物動態の指標となります。 |
|
※77 |
PKプロファイル:薬を投与したあとに体内でどのように吸収・分布・代謝・排泄(ADME)されるかを時間的に示したものです。血中薬物濃度の推移(濃度–時間曲線)として表され、薬の効果や安全性を評価する上で重要な指標となります。 |
|
※78 |
Verified Market Reports. (2025). Secondary Progressive Multiple Sclerosis Drug Market Insights [Web page].(https://www.verifiedmarketreports.com/product/secondary-progressive-multiple-sclerosis-drug-market/ 最終アクセス日 2025年10月28日) |
|
※79 |
Pipeline Therapeutics Announces Global License and Development Agreement for Investigational Neuroscience Therapy, PIPE-307 (https://jnjinnovation.com/news/press-releases/pipeline-therapeutics-announces-global-license-and-development-agreement-for-investigational-neuroscience-therapy-pipe307 最終アクセス日 2025年10月28日) |
|
※80 |
Sanofi Annual Report on Form 20-F 2017. Sanofi press release “Sanofi completes Principia Biopharma Inc. acquisition”, September 28, 2020. Francesco M.R., et al. PRN2246, a potent and selective blood–brain barrier–penetrating BTK inhibitor, exhibits efficacy in central nervous system immunity. Poster presented at the 7th Joint ACTRIMS–ECTRIMS Meeting (MSParis 2017); October 25–28, 2017; Paris, France. Contineum Therapeutics Press Release “Pipeline Therapeutics Announces Global License and Development Agreement for Investigational Neuroscience Therapy, PIPE-307”, April 17, 2023. |
|
※81 |
KRAS変異大腸がん:大腸がんは、RAS遺伝子(KRAS、NRAS、HRAS)に変異がない野生型と変異がある変異型に分けられます。KRAS変異大腸がんは、大腸がんの約35-40%を占め、大腸がんの有効な治療法の一つである抗EGFR抗体薬の効果がありません。 |
|
※82 |
Justin Mencel, ASCO Daily News, January 5, 2023. (https://dailynews.ascopubs.org/do/targeting-kras-g12c-significant-milestone-metastatic-colorectal-cancer-but-work-remains 最終アクセス日 2025年10月28日) |
|
※83 |
J. Gong et al., "RAS and BRAF in metastatic colorectal cancer management" J Gastrointest Oncol., 2016, 7, 687–704.; F. Meric-Bernstam et al., "MyPathway HER2 Basket Study: Pertuzumab + Trastuzumab treatment of a large, tissue-agnostic cohort of patients with HER2-positive advanced solid tumors." Presented at the American Society of Clinical Oncology (ASCO) Annual Meeting; 2021 Jun 4–8; Virtual. Abstract 3004. |
|
※84 |
Y. Shibasaki et al., "Association of High LAT1 Expression with Poor Prognosis and Recurrence in Colorectal Cancer Patients Treated with Oxaliplatin-Based Adjuvant Chemotherapy" Int J Mol Sci., 2023, J24, 2604.; H. Ogawa et al., "Role of Amino Acid Transporter Expression as a Prognostic Marker in Patients With Surgically Resected Colorectal Cancer" Anticancer Res., 2019, 39, 2535-2543. |
|
※85 |
P. Kandasamy et al., "Oncogenic KRAS mutations enhance amino acid uptake by colorectal cancer cells via the hippo signaling effector" Mol Oncol., 2021, 15, 2782–2800. |
|
※86 |
N. Okano et al., "First-in-human phase I study of JPH203, an L-type amino acid transporter 1 inhibitor, in patients with advanced solid tumors" Invest New Drugs., 2020, 38, 1495-1506. |
|
※87 |
Z. Haining et al., "Relation of LAT1/4F2hc expression with pathological grade, proliferation and angiogenesis in human gliomas" BMC Clin Pathol., 2012, 12, Article number: 4. |
|
※88 |
大腸がん - Precedence Research, 2024. “Colorectal Cancer Therapeutics Market Size and Forecast 2025 to 2034” (https://www.precedenceresearch.com/colorectal-cancer-therapeutics-market) グリオーマ – Transparency Market Research, 2022, “Glioma Treatment Market” (https://www.transparencymarketresearch.com/glioma-treatment-market.html) (各出所の最終アクセス日: 2024年12月9日) |
|
※89 |
社内非公開レポート |
4【関係会社の状況】
該当事項はありません。
5【従業員の状況】
(1)提出会社の状況
|
|
|
|
|
2026年1月31日現在 |
|
従業員数(名) |
平均年齢(歳) |
平均勤続年数(年) |
平均年間給与(千円) |
|
|
|
( |
|
|
|
(注)1.従業員数は就業人員(委任契約である参与を含む)を記載しております。
また、臨時従業員(アルバイト、パートタイマーを含み、派遣社員は除く)は、最近1年間の平均人員を()内に外数で記載しております。
なお、最近日までの1年間において従業員数が5名増加しております。主な理由は、臨床開発の進捗に伴う業務拡大、及びSLCトランスポーター創薬のプラットフォーム化への対応等のため期中採用が増加したことによるものであります。
2.平均年間給与は、基準外賃金を含んでおります。
3.当社は創薬事業の単一セグメントであるため、セグメント情報との関連については、記載しておりません。
(2)労働組合の状況
当社において労働組合は存在しませんが、労使関係については円滑な関係にあります。
(3)管理職に占める女性労働者の割合、男性労働者の育児休業取得率及び労働者の男女の賃金の差異
当社は、「女性の職業生活における活躍の推進に関する法律(平成27年法律第64号)」及び「育児休業、介護休業等育児又は家族介護を行う労働者の福祉に関する法律(平成3年法律第76号)」の規定による公表義務の対象ではないため、記載を省略しております。