第二部【企業情報】
第1【企業の概況】
1【主要な経営指標等の推移】
(1)連結経営指標等
|
回次 |
第3期 |
第4期 |
|
|
決算年月 |
2023年12月 |
2024年12月 |
|
|
事業収益 |
(千円) |
|
|
|
営業損失(△) |
(千円) |
△ |
△ |
|
経常損失(△) |
(千円) |
△ |
△ |
|
親会社株主に帰属する当期純損失(△) |
(千円) |
△ |
△ |
|
包括利益 |
(千円) |
△ |
△ |
|
純資産額 |
(千円) |
△ |
△ |
|
総資産額 |
(千円) |
|
|
|
1株当たり純資産額 |
(円) |
△ |
△ |
|
1株当たり当期純損失(△) |
(円) |
△ |
△ |
|
潜在株式調整後1株当たり当期純利益 |
(円) |
|
|
|
自己資本比率 |
(%) |
|
|
|
自己資本利益率 |
(%) |
|
|
|
株価収益率 |
(倍) |
|
|
|
営業活動によるキャッシュ・フロー |
(千円) |
△ |
△ |
|
投資活動によるキャッシュ・フロー |
(千円) |
|
△ |
|
財務活動によるキャッシュ・フロー |
(千円) |
|
|
|
現金及び現金同等物の期末残高 |
(千円) |
|
|
|
従業員数 |
(人) |
|
|
|
(外、平均臨時雇用者数) |
( |
( |
|
(注)1.株価収益率については、当社株式は非上場であるため、記載しておりません。
2.潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、当社株式は非上場であり、期中平均株価が把握できないため、また、1株当たり当期純損失であるため、記載しておりません。
3.自己資本比率は、純資産額がマイナスであるため、記載しておりません。
4.自己資本利益率については、親会社株主に帰属する当期純損失が計上されているため、記載しておりません。
5.従業員数は就業人員であり、臨時雇用者数(パートタイマー、人材会社等からの派遣社員を含む。)は、年間の平均人員を( )外数で記載しております。
6.第3期及び第4期の連結財務諸表については、「連結財務諸表の用語、様式及び作成方法に関する規則」(昭和51年大蔵省令第28号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、監査法人アヴァンティアの監査を受けております。
(2)提出会社の状況
|
回次 |
第1期 |
第2期 |
第3期 |
第4期 |
|
|
決算年月 |
2021年12月 |
2022年12月 |
2023年12月 |
2024年12月 |
|
|
事業収益 |
(千円) |
|
|
|
|
|
営業損失(△) |
(千円) |
△ |
△ |
△ |
△ |
|
経常損失(△) |
(千円) |
△ |
△ |
△ |
△ |
|
当期純損失(△) |
(千円) |
△ |
△ |
△ |
△ |
|
資本金 |
(千円) |
|
|
|
|
|
発行済株式総数 |
(株) |
|
|
|
|
|
普通株式 |
|
|
|
|
|
|
A種種類株式 |
|
|
|
|
|
|
純資産額 |
(千円) |
|
|
|
|
|
総資産額 |
(千円) |
|
|
|
|
|
1株当たり純資産額 |
(円) |
|
|
|
|
|
1株当たり配当額 |
(円) |
|
|
|
|
|
(うち1株当たり中間配当額) |
( |
( |
( |
( |
|
|
1株当たり当期純損失(△) |
(円) |
△ |
△ |
△ |
△ |
|
潜在株式調整後1株当たり当期純利益 |
(円) |
|
|
|
|
|
自己資本比率 |
(%) |
|
|
|
|
|
自己資本利益率 |
(%) |
|
|
|
|
|
株価収益率 |
(倍) |
|
|
|
|
|
配当性向 |
(%) |
|
|
|
|
|
従業員数 |
(人) |
|
|
|
|
|
(外、平均臨時雇用者数) |
( |
( |
( |
( |
|
(注)1.第4期の期末以降、第三者割当増資及びA種種類株式の取得事由の発生による普通株式への転換が行われた結果、資本金は4,131,360千円、発行済株式総数は普通株式33,335,702株となりました。
2.潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの当社株式は非上場であるため期中平均株価が把握できず、また、1株当たり当期純損失であり希薄化効果を有しないため、記載しておりません。
3.自己資本利益率については、当期純損失であるため記載しておりません。
4.株価収益率については、当社株式は非上場であるため、記載しておりません。
5.1株当たり配当額及び配当性向については、当社は配当を実施していないため記載しておりません。
6.第1期、第2期、第3期及び第4期の財務諸表については、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59号)に基づき作成しております。なお、第3期及び第4期の財務諸表については、金融商品取引法第193条の2第1項の規定に基づき、監査法人アヴァンティアによる監査を受けておりますが、第1期及び第2期の財務諸表については、当該監査を受けておりません。
7.従業員数は就業人員であり、臨時雇用者数(パートタイマー、人材会社等からの派遣社員を含む。)は、年間の平均人員を( )外数で記載しております。
8.当社は2021年1月5日設立のため、第1期の会計期間は、2021年1月5日から2021年12月31日までの11ヶ月と27日となっております。
(参考情報)コーポレート・インバージョンによる当社グループ再編及びInnovacell Biotechnologie AGの経営指標等
当社グループは、2021年2月に、当社の親会社(当時)であったInnovacell Biotechnologie AG(オーストリア)と、当社の子会社(当時)であったInsanna AG(オーストリア)との間で、Innovacell Biotechnologie AGを吸収合併消滅会社、Insanna AGを吸収合併存続会社とし、その対価として当社の普通株式をInnovacell Biotechnologie AGの株主に割当交付する三角合併を実施したことにより、Innovacell Biotechnologie AGを完全子会社化いたしました。吸収合併存続会社であるInsanna AGは、合併後に社名をInnovacell AGに変更し、さらに2023年7月に法人格の変更を行なってInnovacell GmbHとなって現在に至っています。
このグループ再編の狙いとして、日本における資金調達がありました。当時Innovacell Biotechnologie AGは、欧州での資金調達環境が厳しかったこともあり、ICEF15の第Ⅲ相国際共同治験を始めとする研究開発活動を推進するための資金を日本で調達するための検討を進めておりました。最終的には、コーポレート・インバージョンによってInnovacell Biotechnologie AGの完全親会社を日本に設立して当該親会社の株式を東京証券取引所に上場することで幅広く投資家の皆様から資金を調達することが日本における最善の資金調達手段であるという結論に至り、当該コーポレート・インバージョンを実施しました。
なお、2024年12月期末時点で、当社グループは当社とInnovacell GmbHの2社で構成されています。
当社は、当社グループ統括機能、日本における事業推進機能、資金調達機能を主に担っております。また、当社グループ研究開発パイプラインポートフォリオ構築・拡充・管理機能、事業開発機能(ライセンシング、事業提携など)も当社の機能です。さらに、当社は、日本における事業推進主体でもあります。
一方、当社子会社であるInnovacell GmbHは、現在当社グループが手がけている3つのパイプラインの研究開発活動をこれまで主導してきており、現在も当社グループ研究開発統括機能を担っております。また、同社は、当社グループの欧州地域拠点として、欧州における臨床開発機能及び自社GMP(※1)製造施設を活用した細胞治療(※2)・再生医療(※3)製品製造機能も有しています。
参考として、合併前の存続会社であったInnovacell Biotechnologie AGの経営指標等を掲載いたします。
|
回次 |
第17期 |
|
|
決算年月 |
2020年12月 |
|
|
事業収益 |
(千円) |
70,900 |
|
営業損失(△) |
(千円) |
△458,654 |
|
経常損失(△) |
(千円) |
△541,769 |
|
当期純損失(△) |
(千円) |
△542,214 |
|
資本金 |
(千円) |
278,528 |
|
発行済株式総数 |
(株) |
2,194,001 |
|
純資産額 |
(千円) |
△1,174,356 |
|
総資産額 |
(千円) |
628,312 |
|
1株当たり純資産額 |
(円) |
△535.26 |
|
1株当たり配当額 |
(円) |
- |
|
(うち1株当たり中間配当額) |
(-) |
|
|
1株当たり当期純利益(△は損失) |
(円) |
△247.13 |
|
潜在株式調整後1株当たり当期純利益 |
(円) |
- |
|
自己資本比率 |
(%) |
- |
|
自己資本利益率 |
(%) |
- |
|
株価収益率 |
(倍) |
- |
|
配当性向 |
(%) |
- |
|
従業員数 |
(人) |
22 |
(注)1.「円」で表示されている金額は、2020年12月末日現在のTTMに基づき、1ユーロ126.95円で換算された金額であります。この換算は、本書を読む投資者の便宜のためのものであり、その金額が上記の相場で実際に日本円に交換されたり、交換できたであろうというように解するべきものではありません。
2.潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、同社株式は非上場であり、期中平均株価が把握できないため、また、1株当たり当期純損失であるため記載しておりません。
3.自己資本比率は、純資産額がマイナスであるため、記載しておりません。
4.自己資本利益率については、当期純損失を計上しているため記載しておりません。
5.株価収益率については、同社株式は非上場であるため、記載しておりません。
6.1株当たり配当額及び配当性向については、配当を行なっていないため記載しておりません。
7.同社の財務諸表については、日本の金融商品取引法に基づく会計監査を受けておりません。
2【沿革】
当社グループの母体はオーストリア共和国のインスブルック医科大学からスピンアウトした細胞治療・再生医療研究開発企業(旧Innovacell Biotechnologie AG、現在は社名をInnovacell GmbHに変更)であり、当社はこのオーストリア企業の親会社となるべく2021年1月に日本で設立されました。なお、本書提出日現在、インスブルック医科大学の教授等は当社グループの事業運営には関与しておらず、当社株式の保有やその他権利関係もありません。
<当社前身企業(現Innovacell GmbH)の沿革>
|
年月 |
内容 |
|
2000年11月 |
オーストリア共和国インスブルック市においてInnovacell Biotechnologie GmbHを設立 |
|
2005年5月 |
自社製造施設に関するGMP認証を取得(2007年に臨床開発開始に伴うGMP製造をスタート) |
|
2008年8月 |
法人格を変更(Innovacell Biotechnologie GmbHからInnovacell Biotechnologie AGへ) |
|
2011年6月 |
腹圧性尿失禁を対象とした自家骨格筋由来細胞製品(ICES13)の後期第Ⅱ相試験を完了 |
|
2016年10月 |
切迫性便失禁を対象とした自家骨格筋由来細胞製品(ICEF15)の後期第Ⅱ相試験を完了 |
|
2019年10月 |
主要株主が交替(事業推進力向上のため、欧州機関投資家等中心の構成から当社取締役等中心の構成へ(シリーズB資金調達を実施)) |
|
2021年2月 |
三角合併を完了(当社の完全子会社となり、社名をInnovacell AGに変更(注)) |
|
2022年5月 |
切迫性便失禁を対象とした自家骨格筋由来細胞製品(ICEF15)の第Ⅲ相国際共同治験における欧州での患者組み入れを開始(日本における開発準備は2017年より開始) |
|
2022年6月 |
欧州投資銀行から1,500万ユーロのベンチャーデットを調達 |
|
2022年9月 |
厚生労働省より「再生医療等の安全性の確保等に関する法律」第39条第1項に基づく「特定細胞加工物製造認定」を取得(欧州に立地する施設として初めて) |
|
2023年7月 |
法人格を変更(Innovacell AGからInnovacell GmbHへ) |
(注) 当社の親会社(当時)であったInnovacell Biotechnologie AG(オーストリア)と、当社の子会社(当時)であったInsanna AG(オーストリア)との間で、Innovacell Biotechnologie AGを吸収合併消滅会社、Insanna AGを吸収合併存続会社とし、その対価として当社の普通株式をInnovacell Biotechnologie AGの株主に割当交付する三角合併を実施したことにより、Innovacell Biotechnologie AGを完全子会社化いたしました。吸収合併存続会社であるInsanna AGは、合併後に社名をInnovacell AGに変更し、さらに2023年7月に法人格の変更を行なってInnovacell GmbHとなって現在に至っております。
<当社の沿革>
|
年月 |
内容 |
|
2021年1月 |
当社(イノバセル株式会社)を設立(資本金2百万円) |
|
2021年2月 |
三角合併の完了により、Innovacell AG(当時)の完全親会社となる |
|
2022年7月 |
累計27億円の調達をもって、シリーズC資金調達をクローズ |
|
2023年8月 |
現在の経営体制への移行を完了 |
|
2023年9月 |
便失禁を対象とした自家骨格筋由来細胞製品(ICEF15)の第Ⅲ相国際共同治験における日本での患者組み入れを開始 |
|
2024年11月 |
アルフレッサ株式会社より出資を受け入れ、業務提携基本契約を締結 |
|
2025年8月 |
累計73億円の調達をもって、シリーズD資金調達をクローズ |
3【事業の内容】
(1)対象とする事業領域
当社グループは、有望な医薬品や医療機器などのシーズを世界各国で探索・発掘、それらを自社のパイプラインに組入れて開発し、グローバル市場において商業化することを通じて、患者さまの健康とQOLの向上に貢献することを主な目的とする企業です。現在はまず、当社グループの基幹技術とも言える、ヒト細胞を用いた細胞治療製品より成るパイプラインに注力して研究開発を進めております。
現在当社グループが手掛けているヒト細胞を用いた細胞治療製品は、日本では「再生医療等製品」、欧州では「ATMP(Advanced Therapy Medicinal Products)(※4)」、米国では「HCT/P(Human Cells, Tissues, and Cellular and Tissue-based Products)(※5)」として分類されております。
なお、当社の事業セグメントは「細胞治療・再生医療研究開発事業」のみです。
(2)事業の概要
① 当社グループの技術とパイプラインの概要
当社グループは設立以来、ヒト骨格筋細胞の培養技術の研究に取り組んでおり、患者さまご自身の筋組織を採取し、筋肉の幹細胞である衛星細胞から筋芽細胞を調製して、損傷あるいは機能が低下した標的筋組織へ注入することで機能再生を図る臨床応用へと発展させました。また、筋芽細胞の調製においては、GMPに準拠した施設を立ち上げ、医薬品に求められる高い品質で細胞製品を供給する技術を確立しております。
現在のパイプラインは失禁領域(尿失禁・便失禁)に焦点をあて、ICEF15(ターゲット疾患:切迫性便失禁)、ICEF16(同:漏出性便失禁)及びICES13(同:腹圧性尿失禁)の3つのパイプラインの研究開発に取り組んでいます。その中で最も開発ステージが進んでいるパイプラインはICEF15であり、現在第Ⅲ相国際共同治験を実施しております。
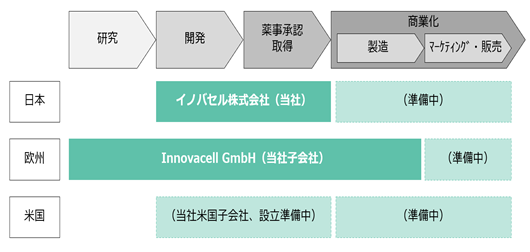
② グループ会社の役割
当社グループは、当社及び当社子会社(Innovacell GmbH)の2社から構成されています。
当社は、グループ統括会社としての機能の他、日本における研究開発機能、及びグローバル事業開発機能を兼ね備えております。また開発が最も進んでいるICEF15について、当社は国際共同治験への参加国の1つである日本における臨床開発業務を推進しています。
事業開発の一環としては、当社グループ全体の研究開発パイプラインの構築・拡充・管理と、それぞれのパイプラインに関する事業パートナリング活動(ライセンシング、共同販売、事業提携など)を推進しています。現在、ICEF15の商業化へ向けた準備として複数の製薬企業との間で共同販売促進提携交渉を推進しています。また当社は、当社グループの運営に必要な資金の調達も担っております。
当社子会社であるInnovacell GmbHは、現在当社グループが手がけている3つのパイプラインの研究開発活動を主導しております。同社は2000年の設立以来一貫して、失禁領域を対象とした細胞治療製品の基礎研究と臨床開発を進めており、3つの研究開発パイプラインはいずれもInnovacell GmbHから誕生したものです。すなわち同社は当社グループの欧州地域の開発拠点であり、現在臨床段階に入っている2つのパイプラインにおいて、欧州医薬品庁(European Medicines Agency)及び欧州各国の薬事当局への対応を担当してきました。
さらに、同社はGMP製造施設を保有しており、これまでに骨格筋細胞、結合組織細胞、樹状突起細胞、毛嚢細胞など様々な種類の細胞製品の受託製造を行なってきた経験を有しています。当該GMP製造施設は、2022年9月に日本の厚生労働省より「再生医療等の安全性の確保等に関する法律」第39条第1項に基づく「特定細胞加工物製造認定」をアジア以外に立地する施設として初めて取得し、日本の法規制に基づく特定細胞加工物の製造も受託できるようになりました。この他同社は、2022年6月に欧州連合(EU)の政策金融機関である欧州投資銀行(European Investment Bank)から1,500万ユーロ(調達時の為替レート換算で約21億円)のベンチャーデットを調達するなど、公的資金を活用してきた実績も有します。
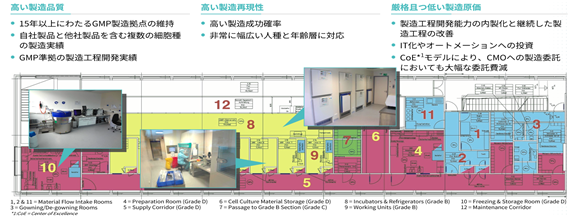
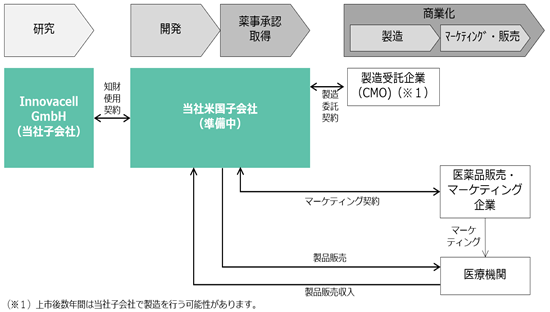
現在当社グループは進行中のICEF15の国際共同治験に米国の臨床施設を追加する準備を進めており、また同国における商業化の準備も推進しています。米国の臨床施設が追加される事で、ICEF15の国際共同治験は日本・米国・欧州の主要3極を跨ぐ体制となります。また、今後当社米国子会社を設立し、米国における各種活動を担う計画です。
<当社グループにおける事業機能分担>
③ ビジネスモデル・収益構造
当社は、世界各国の有望な医薬品・医療機器シーズを探索・発掘し、グローバルに開発して商業化する独自の「グローバルアグリゲーションモデル」を事業モデルとしています。
「グローバルアグリゲーションモデル」とは、専門的知見・経験や人的ネットワーク等に基づいて、有望な商業化ポテンシャルを有するシーズをグローバルに発掘、自社パイプラインに組入れ、当該パイプラインの開発に必要な事業インフラをグローバルに調達し、さらに当該パイプラインに最適なビジネスモデルを構築した上で商業化していくことにより、自らの収益ポートフォリオを構築・拡充するという事業モデルです。現在当社グループが手掛けている3つの失禁領域のパイプラインはこの「グローバルアグリゲーションモデル」の最初の適用事例であり、日本企業である当社がこれら3つのパイプラインの研究開発を行なっているオーストリア企業(現Innovacell GmbH)を子会社化して現在のグループ事業体制を構築しました。
当社研究開発パイプラインの中で最も商業化に近いステージにあるのはICEF15であり、現在日本及び欧州において第Ⅲ相国際共同治験を実施しています。
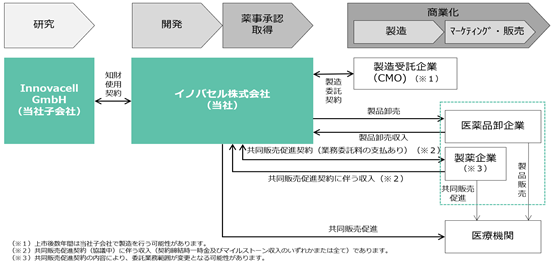
このICEF15について、日本で当社は薬事承認取得に至るまでの開発を自社で行い、薬事承認取得後に必要となる各種商業化機能(商業製造、マーケティング・販売など)の多くを経験豊富な外部提携先に委託する計画です。製薬企業と共同販売促進契約を締結した場合、当社は当該契約に基づいて契約締結時一時金及びマイルストーン収入を受領することが期待されます。また、当社は当該契約先企業と共同で販売促進活動を行なって製造委託先で製造した製品を医薬品卸企業に販売し、製品卸売収入を得る計画です。
<日本におけるICEF15事業系統図(想定)>
<欧州におけるICEF15事業系統図(想定)>
ICEF15について、米国においても欧州と同じ商業化サービス提供企業への委託を想定しておりますが、商業製造についても外部に委託する点が欧州と異なります。
<米国におけるICEF15事業系統図(想定)>
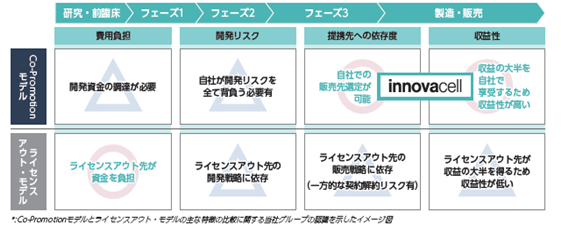
<ご参考:Co-Promotionモデルとライセンスアウト・モデルの比較>
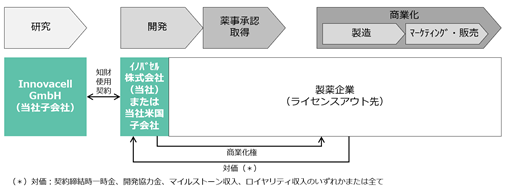
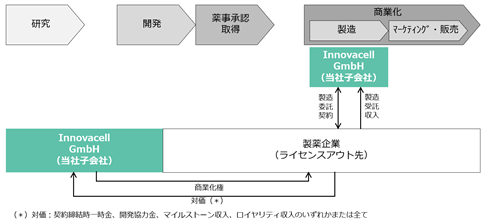
ICEF15以外のパイプラインについては、今後の開発の進捗を踏まえながら最適なビジネスモデルを構築する方針です。ICEF15同様、薬事承認取得に至るまでの開発を自ら行う計画であるものの、開発費負担の軽減などを目的として開発途中のパイプラインをライセンスアウトした場合、下図のようなビジネスモデルが想定されます。この場合、当社は対象パイプラインの商業化権を製薬企業に譲渡し、その対価として契約締結時一時金、開発協力金、マイルストーン収入、ロイヤリティ収入のいずれかまたは全てを受領することになります。日本及び米国のモデルと欧州のモデルとの違いはライセンスアウト先が商業製造を受託するかどうかという点であり、商業製造を受託する欧州では当社子会社が製造受託収入を得ることが想定されます。
<ICEF15以外のパイプライン(日本または米国においてライセンスアウト・モデルを採用した場合)>
<ICEF15以外のパイプライン(欧州においてライセンスアウト・モデルを採用した場合)>
<当社グループの主な収益>
|
|
収益種類 |
内容 |
|
A |
製品卸売収入 |
製品を医薬品卸企業に対して販売した対価として得られる収入 |
|
B |
製品販売収入 |
製品を医療機関に対して販売した対価として得られる収入 |
|
C |
契約締結時一時金 |
共同販売促進提携契約やライセンスアウト契約などを締結した時に一時金として得られる収入 |
|
D |
開発協力金 |
パイプライン開発費用のうちライセンスアウト先負担分として受領する収入 |
|
E |
マイルストーン収入 |
開発や販売の進捗に応じて設定されたマイルストーンを達成するごとに一時金として得られる収入 |
|
F |
ロイヤリティ収入 |
ライセンスアウト先製品売上高の一部をロイヤリティとして受け取る収入 |
|
G |
製造受託収入 |
製品製造を受託した対価として得られる収入 |
④ 各パイプラインの進捗状況
現在当社グループは、失禁領域(便失禁、尿失禁)をターゲットとする下記3つの自家細胞治療製品から成るパイプラインの研究開発に取り組んでおります。
・ICEF15(ターゲット疾患:切迫性便失禁)
・ICEF16(ターゲット疾患:漏出性便失禁)
・ICES13(ターゲット疾患:腹圧性尿失禁)
これら研究開発パイプラインのうちで最も進んだ開発ステージ(第Ⅲ相国際共同治験)にあるのは、切迫性便失禁をターゲットとするICEF15です。また、腹圧性尿失禁をターゲットとするICES13は欧州において後期第Ⅱ相臨床試験を終えた段階にあります。漏出性便失禁をターゲットとするICEF16は、現在第Ⅰ/Ⅱ相試験準備を行なっている段階です。
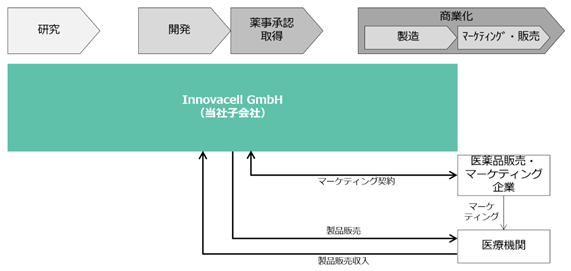
ICEF15について、欧州においても当社グループは薬事承認取得に至るまでの開発を自ら行いますが、薬事承認取得後に必要となるマーケティング・販売機能に関しては外部提携先に委託する計画です。現在想定している外部提携先は、これまでに終了した臨床試験をもとに薬事承認取得及び商業化に必要なサービスを一気通貫かつ統合的に提供する企業であり、商業化権を製薬企業等に譲渡する「ライセンスアウト」方式、自前で販売・マーケティングに必要な組織及びインフラを構築して商業化した製品を自ら販売する「自販」方式のいずれでもない第三の商業化選択肢を提供しています。具体的にはInnovacell GmbH(当社子会社)が当該外部提携先と商業化サービス契約を締結し、当該商業化サービスを活用しながら製品を病院に販売して製品販売収入を得る想定です。また、Innovacell GmbHが既にGMP製造施設を有していることから、欧州においては薬事承認取得後も同社においてICEF15の商業製造を行う計画です。日本及び米国に関して一定期間経過後は外部提携先に製造を委託する予定です。欧州において外部提携先との契約に基づく一時金収入等の受領は想定しておりませんが、グループ内で商業製造を行うことによって外部に製造委託する場合よりも高い収益性を確保する可能性を念頭に置き、現在契約締結に向け各社と協議中です。
(3)当社グループの特徴
事業モデルの基盤となっている当社グループの特徴は以下のとおりです。
① バリューチェーンの各段階において常にグローバル市場を対象としていること
当社グループの起源は、2000年にオーストリア共和国のインスブルック医科大学からスピンアウトした細胞治療・再生医療研究開発企業Innovacell Biotechnologie GmbH(現Innovacell GmbH)に遡ります。この企業は、ヒト骨格筋細胞の培養における先進的な研究成果を基盤に設立され、以来、臨床応用を目指した細胞治療製品の開発に取り組んでまいりました。
当社は、このオーストリア企業の親会社として、日本における資金調達及びグローバルな事業展開を加速させるべく、2021年1月に日本で設立されました。設立以来、日米欧の医療・バイオテクノロジー市場を対象とした戦略的な事業運営を行なっております。
また、当社の取締役はオーストリア、米国、日本といった複数の国籍を持つメンバーが名を連ねており、それぞれが日米欧いずれかの地域で細胞治療・再生医療関連企業の経営に携わった経験を有しております。これにより、各地域の医療制度、規制環境、商習慣に精通した多角的な視点から、事業戦略の立案と実行が可能となっております。
このような背景から、当社の事業運営は創業当初からグローバル志向であり、シーズの探索・発掘、パイプラインの研究や臨床開発、商業化といった各ステージにおいて、常にグローバル市場を視野に入れて活動しております。
② 専門的知見・経験に裏打ちされた独自の調査・分析に基づくシーズの特定とパイプラインポートフォリオの構築
当社グループは、細胞治療・再生医療分野における豊富な知見と実績を社内に蓄積しており、これらが当社グループ事業戦略の基盤を形成しています。
まず、当社代表取締役Co-CEO2名は、約10年にわたる細胞治療・再生医療薬事コンサルタントとしての経験を通じて、主に日本、米国、欧州の細胞治療・再生医療の研究開発シーズに関する包括的且つ実践的な知識を有しており、さらに国内外の細胞治療・再生医療関連企業の経営陣との間に強固な人的ネットワークを構築しております。これらはいずれも当社グループの事業展開における重要なアセットとなっています。
加えて、当社子会社のInnovacell GmbHは、20年以上にわたり細胞治療製品の研究開発に従事してきた企業であり、同分野における技術的・臨床的な知見を豊富に有しています。同社は、自社のGMPに準拠した製造施設と技術基盤を活用し、他社への製造技術の供与や研究開発用細胞治療製品の受託製造など、多様な形態での事業展開を行なってきた実績があります。
当社は、これらの知見・経験を活かし、独自の調査・分析に基づいて、アンメット・メディカル・ニーズ(※6)が存在する疾患領域において、有望な商業化ポテンシャルを有するシーズを発掘し、研究開発パイプラインを構築・拡充しながら同時に全体としてのリスクヘッジも図るというポートフォリオの構築に取り組んでおります。
さらに、これらの知見・経験に基づいて世界各国の法規制の特徴や製品・製剤開発に必要な各種事業インフラの整備状況等を把握した上で、パイプラインそれぞれの開発を効率よく推進し、グローバル市場で商業化することを目指しております。
現在は、ターゲット疾患として失禁領域(切迫性便失禁、漏出性便失禁、腹圧性尿失禁)に焦点を当て、当社子会社のInnovacell GmbHが研究開発を進めてきた3つのパイプラインの開発及び商業化に注力しております。
③ 「個別のパイプラインに最適なビジネスモデルの構築」が付加価値となること
2000年代以降、世界各国で細胞治療・再生医療製品の商業化が進むと同時に、製造設備、品質管理、物流、薬事規制対応などの事業インフラが各国で整備されてきました。将来有望な市場であるが故に新規参入が相次ぎ、業界全体としては前向きなトレンドが続いています。一方で、なお成長過程にある産業であるため、各国における企業や規制当局の成熟度にはばらつきが生じており、国・機関・ベンダーごとに品質や運用、スピードが大きく異なるのが実情です。
その結果、「どのようにしてこれらの外部インフラの中から最適なものを選定・調達し、いかに低コストで早期に自社のパイプラインを商業化するか」が各国の細胞治療・再生医療関連企業に共通する重要課題の1つとなっています。即ち、何を内製し何を外製するか、どこと組むか、どの順序で拡張するか等の戦略立案と実行が、細胞治療・再生医療関連企業の競争力を左右します。
このような認識の下、当社は、当社グループ内に蓄積されている知見・経験・ネットワークを活用し、常にグローバルな視野で自社の各パイプラインの開発・商業化に必要な各種資源(スキル・人材、開発支援サービス、事業パートナー、資金)の組み合わせの最適化を目指しています。換言すると、当社の付加価値は「個々のパイプラインに最適なビジネスモデルを構築して当該パイプラインを商業化すること」であるということができます。
(4)事業の内容
① 当社グループ研究開発領域
現在当社グループは、失禁領域(便失禁、尿失禁)をターゲットとするいずれも自家骨格筋由来の3種類の細胞治療製品から成るパイプラインの開発・商業化に取り組んでいます。
これらの研究開発パイプラインがターゲットとする失禁領域には、以下のような共通する特徴があります。
A)アンメット・メディカル・ニーズが存在すること
失禁に対する既存の治療法は複数存在しますが,生活の質(QOL)を大きく低下させる病気ではあるものの、良性の病態である(生命を脅かす病気ではない)ことからできるだけ侵襲性(※7)の低い治療法から順に選択すべきとされています。
日本の便失禁診療ガイドラインによると、比較的軽度の失禁症状には保存的療法(食事・生活・排便習慣指導、薬物療法、骨盤底筋訓練、バイオフィードバック療法など)が用いられますが、保存的療法で充分な改善が得られない場合には外科的治療が適用されます。
しかしながら、既存の外科的治療(肛門括約筋形成術、仙骨神経刺激療法など、下記参照)はいずれも侵襲性があり、また効果も限定的であるという報告もあり、必ずしも全ての患者さまには好まれないことが知られています。
●肛門括約筋形成術:断裂した肛門括約筋(肛門を閉める筋肉)を縫い合わせる外科手術
●仙骨神経刺激療法:心臓ペースメーカに似た刺激装置を体内に埋め込み、仙骨神経(排尿や排便に関わる感覚や運動を制御)を継続的に電気刺激する療法
したがって、保存的療法で充分な効果を得られない患者さまに対して治療効果が高くかつ侵襲性が低い新たな治療法が待ち望まれており、現在もアンメット・メディカル・ニーズが存在すると考えられます。

B)多くの潜在患者が存在すると推測されること
失禁とは、便または尿が漏れることをコントロールできない状態(無意識あるいは不随意な便または尿の漏れであり、それが社会的にも衛生的にも問題となる状態)と一般的に定義されています。
失禁は、日常生活に多大な影響を及ぼす症状でありながら患者さま自身が検査や治療を求めて医療機関を訪れることは比較的少なく、「Silent Affliction(言葉にされないままの悩み)」と呼ばれることがあります。その原因として、良性の疾患であること、患者さまが羞恥心などから他人に話すことに抵抗を感じること、治療によって症状が改善する可能性があることが患者さまのみならず医療関係者の間ですらあまり知られていないこと、などが挙げられます。
日本国内には約500万人の便失禁の患者さまが存在すると言われており(出所:日本大腸肛門病学会誌)、また日本人女性の約1,580万人が腹圧性尿失禁症状を有しているとされています(出所:Mitsui et al “Prevalence and impact on daily life of lower urinary tract symptoms in Japan: Results of the 2023 Japan Community Health Survey (JaCS 2023)”, International Journal of Urology (2024) 31,747-754 及び総務省統計局人口推計(2024年10月1日現在)より当社算出)が、上述の理由からこれら失禁に悩む方々の多くが適切な治療を受けていない状態にあると推測されます。つまり、失禁領域には多くの潜在患者が存在すると考えられます。
C)類似する競合品が少ないニッチセグメントであること
当社が開発している3つの研究開発パイプラインはいずれも患部である筋肉組織に細胞を注入(筋注)することによる治療法です。投与は単回投与を想定しています。したがって、薬事承認が取得できれば既存の外科的治療の中では最も侵襲性が低いものになると考えられます。また、現時点において日米欧いずれかで承認済みとなった競合品は存在しません。市場においては現在複数の細胞治療製品の研究開発が行われていることが知られておりますが、いずれも当社パイプラインよりも遅れた開発ステージにあります。従いまして、当社パイプラインは他の開発品よりも早く上市される可能性が高い点で先行優位性を有していると考えています。
② 現在の当社グループ研究開発パイプラインの全体像
現在当社グループは、失禁領域(便失禁、尿失禁)をターゲットとする以下、3つの自家骨格筋由来の細胞治療パイプラインの研究開発に取り組んでいます。
・ICEF15(ターゲット疾患:切迫性便失禁、用いる細胞の種類:自家骨格筋由来細胞(aSMDC))
・ICEF16(ターゲット疾患:漏出性便失禁、用いる細胞の種類:自家骨格筋由来平滑筋細胞(skSMC))
・ICES13(ターゲット疾患:腹圧性尿失禁、用いる細胞の種類:自家骨格筋由来細胞(aSMDC))
これら3つの研究開発パイプラインは、いずれも失禁症状の根本原因の1つである筋肉の機能を回復して根治を目指す治療法である点で共通しております。
これら研究開発パイプラインのうち、2つは臨床段階にあります。切迫性便失禁をターゲットとするICEF15は最も進んだ開発ステージである第Ⅲ相国際共同治験を2022年5月に開始しました。また、腹圧性尿失禁をターゲットとするICES13は欧州において2011年6月に後期第Ⅱ相臨床試験を終えた段階にあります。漏出性便失禁をターゲットとするICEF16は、現在第Ⅰ/Ⅱ相試験の準備を行なっている段階です。
<当社の研究開発パイプライン>

③ ICEF15の開発状況
A)ターゲット疾患
ICEF15のターゲット疾患は切迫性便失禁です。
便失禁とは無意識または自分の意思に反して肛門から便が漏れる症状と定義され、日本国内には約500万人の便失禁に悩む患者さまが存在すると言われています(出所:一般社団法人日本大腸肛門病学会ウェブサイト)。
便失禁症状は切迫性便失禁と漏出性便失禁及び両者が併存する混合性便失禁に分類されます。このうち切迫性便失禁は、便意を感じるもののトイレに行くまでの短い時間を我慢できずに便が漏れてしまう状態を主な症状とし、外肛門括約筋の機能低下が原因となって生じやすいとされています。専門学会誌に発表された論文(味村俊樹ほか「本邦における便失禁診療の実態調査報告―診断と治療の現状―」日本大腸肛門病会誌 65:101-108,2012)によると、便失禁患者さまのうち半数強(約51%)が切迫性の症状を有しています。
現在切迫性便失禁の診療においては、まず食事・生活・排便習慣の改善や薬物療法(便を固くする薬剤)などの初期保存的療法、及び骨盤底筋訓練、バイオフィードバック療法、経肛門的洗腸療法などの専門的保存的療法を行い、それらの効果が不十分な場合には、肛門括約筋形成術や仙骨神経刺激療法などの外科的治療が適用されます。しかしながら、これらの既存の外科的治療は侵襲性があること、また効果も限定的であるという報告があることなどを背景として必ずしも全ての患者さまには好まれないことが知られており、したがって、保存的療法で充分な効果を得られない患者さまに対する治療効果が高く、かつ侵襲性が低い新たな治療法が待ち望まれています。
B)開発製品の特徴
イ)作用機序
ICEF15で使用する細胞は、患者さまご自身から採取して製造した自家骨格筋由来細胞(aSMDC)です。骨格筋由来細胞は筋組織の幹細胞である衛星細胞から分化、増殖させた筋芽細胞であり、注入された筋芽細胞は患部に残っている筋管(注:筋線維の単位)と融合して骨格筋の再生を促します。この細胞は、一旦筋管に取り込まれると、筋繊維の一部として長期にわたり外肛門括約筋の機能維持に寄与すると考えられています。
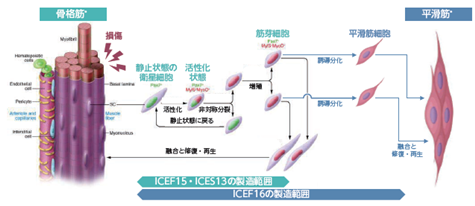
*: 画像の出所-J Clin Invest.2010;120(1):11-19. https://doi.org/10.1172/JCI40373
ロ)投与方法
ICEF15による治療は、麻酔を行い超音波ガイドに基づいて外肛門括約筋層に自家骨格筋由来細胞を12か所に分けて注入します。
現在進行中の臨床試験においては、ICEF15の投与前と投与後に、骨盤底筋電気刺激装置を使用し、1日2回(朝晩20分ずつ)それぞれ4週間の電気刺激を実施します。この電気刺激に用いる装置は欧州では既に承認されているものですが、日本においてはICEF15の承認と併せて当該装置の承認を得る計画です。
C)治験の状況
ICEF15ではこれまでに3つの臨床試験が完了しており、いずれも欧州で実施されました。
最初の試験は2007年から2008年にかけて第Ⅰ/Ⅱ相試験(医師主導試験;非盲検単群試験)として、移植手技の実行可能性と安全性の確認を目的に実施されました。本試験には分娩時損傷によって便失禁となった女性被験者10例が組み入れられました。その結果、試験は安全に実行可能であることが確認されたことに加えて、便失禁の重症度を評価するスケール及び便失禁頻度が細胞移植1か月後より明確に低下し、1年、5年後も再発することなく維持されることが示されました。
次に2011年から2012年にかけて、より幅広い対象として、外肛門括約筋の損傷や萎縮が原因で便失禁となった被験者を対象に、男性5例を含む計39例で第Ⅰ/Ⅱ相試験(企業治験;非盲検単群試験)が実施されました。その結果、先の試験と同様に細胞移植の安全性に懸念はなく、便失禁の重症度を評価するスケール、便失禁頻度、生活の質が細胞移植1か月後から改善し、1年間維持されることが示されました。
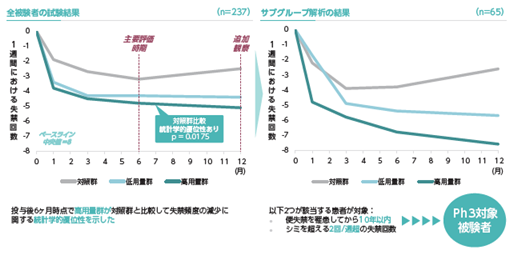
その後2013年から2016年にかけて、用量設定試験として多施設共同プラセボ対照無作為化二重盲検比較試験(STEFFI試験;後期第Ⅱ相試験)が肛門管検査により外肛門括約筋に損傷あるいは機能低下が認められた便失禁患者を対象に男性19例を含む計237例で実施されました。その結果、本試験は対照群を含む高低2用量の計3群より構成されましたが、高用量群でプラセボ対照群と比較し、統計学的に有意なベースライン(投与前)からの便失禁頻度の低下が認められました。また、特に懸念すべき重大な副作用は報告されませんでした。試験終了後の層別解析において、より効果が期待できる患者集団を見い出すことができ、それは現在進行中の第Ⅲ相国際共同治験の選択・除外基準に反映されています。
なお、上記3試験結果はいずれも以下の査読付き学術誌に掲載されています。
第Ⅰ相試験
・Frudinger A, Kölle D, Schwaiger W, et al. Muscle-derived cell injection to treat anal incontinence due to obstetric trauma: pilot study with 1 year follow-up. Gut. 2010; 59(1): 55-61.
・Frudinger A, Pfeifer J, Paede J, et al. Autologous skeletal-muscle-derived cell injection for anal incontinence due to obstetric trauma: a 5-year follow-up of an initial study of 10 patients. Colorectal Dis. 2015; 17(9): 794-801.
・Frudinger A, Marksteiner R, Pfeifer J, et al. Skeletal muscle-derived cell implantation for the treatment of sphincter-related faecal incontinence. Stem Cell Res Ther. 2018; 9(1): 233.
第Ⅱ相試験
・Frudinger A, Gauruder-Burmester A, Graf W, et al. Skeletal Muscle–Derived Cell Implantation for the Treatment of Fecal Incontinence: A Randomized, Placebo-Controlled Study. Clin Gastroenterol Hepatol. 2023; 21(2): 476-486.
また、便失禁診療ガイドラインにおいて、「その他の外科治療」の1つに「肛門括約筋再生療法」が記載され、上記4つの論文が以下の書籍に引用されています。
・便失禁診療ガイドライン 2024年版(改訂第2版),日本大腸肛門病学会 編集,南江堂 : p116-117
欧州での資金調達が長期化したこともあり、コーポレート・インバージョンによる当社グループ再編後の日本での資金調達を行った上で、2022年5月より第Ⅲ相国際共同治験(Fidelia試験)が実施されています。本試験はプラセボ群と実薬群(STEFFI試験の高用量)からなり、参加国は欧州11ヶ国及び日本、目標症例数を290例(無作為割り付け)としています。2025年11月30日現在194例(前連結会計年度末は移植まで完了した患者数は80例)が組入れられております。今後さらに米国を試験実施国に追加する準備を進めています。
なお治験製品は全て当社子会社Innovacell GmbHの製造施設で製造されています。
コーポレート・インバージョンについての詳細は、「第二部 企業情報 第1 企業の概況 (参考情報)コーポレート・インバージョンによる当社グループ再編及びInnovacell Biotechnologie AG の経営指標等」をご参照ください。
D)商業化へ向けた取り組み状況
イ)ターゲット疾患の治療におけるICEF15のポジショニング
日本の便失禁診療ガイドライン2024年版改訂第2版には「便失禁に対する外科治療のアルゴリズムは時代と共に変化しているが、良性の病態であるため、低侵襲な術式から順に選択すべきである」との記述があります。ICEF15を用いた治療法は患部に細胞を注入するものであり、侵襲性が低く、括約筋の再生という作用機序からも既存の外科的治療とは一線を画します。薬事承認が得られ治療実績が積まれた場合には、承認国の便失禁における外科的治療アルゴリズム(※8)において、ICEF15には外肛門括約筋の欠損や機能不全による便失禁に対する外科的手術の第一選択肢として位置づけられる可能性があると考えられます。
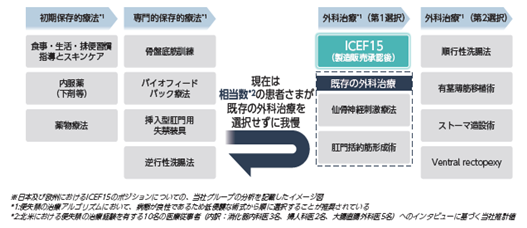
ロ)商業化への取り組み
現在、日本及び欧州のそれぞれにおいて、商業化へ向けて、複数の企業と守秘義務契約及び基本合意書を締結し事業提携交渉を行なっております。
④ ICEF16の開発状況
A)ターゲット疾患
ICEF16のターゲット疾患は漏出性便失禁です。
漏出性便失禁は、便意を伴わず、気づかないうちに便を漏らす症状であり、内肛門平滑筋の機能低下により生じやすいと考えられています。専門学会誌に発表された論文(味村俊樹ほか「本邦における便失禁診療の実態調査報告―診断と治療の現状―」日本大腸肛門病会誌 65:101-108,2012)によると、便失禁患者のうち8割超(約84%)が漏出性の症状を有しています。切迫性便失禁と同様に、食事・生活・排便習慣の改善や薬物療法(便を固くする薬剤)などの初期保存的療法、及び骨盤底筋訓練、バイオフィードバック療法、経肛門的洗腸療法などの専門的保存的療法を行い、それら保存的療法の効果が不十分な場合には肛門括約筋形成術などの外科的治療が適用されます。ICEF16を用いた治療法は、ICEF15を用いた治療法と同様に、既存の外科的治療よりも侵襲性が低いものです。
B)開発中製品の特徴
イ)作用機序
ICEF16で使用する細胞は、患者さまご自身から採取して製造した自家骨格筋由来平滑筋細胞(skSMC)です。平滑筋細胞を採取して十分な量を調製することは困難であるため、最初のステップとしてICEF15と同じ筋芽細胞を調製したのち、平滑筋細胞へ分化させます。この平滑筋へ分化した細胞の特性はin vitro(試験管内)及びin vivo(動物個体内)双方の試験で検証済みです。注入された平滑筋細胞は患部に残っている平滑筋と融合して再生を促します。
ロ)投与方法
ICEF16については、内肛門平滑筋層に平滑筋細胞を注入する計画です。また、ICEF15と同様に、投与前後に電気刺激装置による電気刺激を実施し、投与した細胞の生着を促す計画です。
C)開発の状況
現在、第Ⅰ/Ⅱ相臨床試験開始を目指し非臨床試験を実施している段階です。
既に小動物(マウス)を使用した試験において、投与した骨格筋由来平滑筋細胞が投与部位の平滑筋に生着し、平滑筋としての機能を示すタンパク質を分泌することを確認しており、現在大動物(ミニブタ)を用いて同様の試験を実施しています。
⑤ ICES13の開発状況
A)ターゲット疾患
ICES13のターゲット疾患は腹圧性尿失禁です。
尿失禁で最も多いのは腹圧性尿失禁で、咳、くしゃみ、あるいは運動すること等によって腹腔の圧力が高まった時に自分の意志とは関係なく排尿してしまうことが主な症状です。日本人女性の腹圧性尿失禁の推定有病者数は約1,580万人です(出所:Mitsui et al “Prevalence and impact on daily life of lower urinary tract symptoms in Japan: Results of the 2023 Japan Community Health Survey (JaCS 2023)”, International Journal of Urology (2024) 31,747-754 及び総務省統計局人口推計(2024年10月1日現在)より当社算出)。こうした症状は、主に加齢や出産などで尿道括約筋を含む骨盤底の筋肉(骨盤底筋群)が弱ったり、傷ついたりすることが原因で起こるとされています。
現行の治療法としては、保存的療法(骨盤底筋訓練、バイオフィードバック、ボールトレーニング等)や様々な薬物療法、外科的療法(外科手術や医療機器の埋め込み等)が挙げられます。
B)開発中製品の特徴
イ)作用機序
ICES13で使用する細胞は、患者さまご自身から採取して製造した自家骨格筋由来細胞(aSMDC)です。注入された筋芽細胞は患部に残っている筋管と融合して括約筋の再生を促します。
ロ)投与方法
ICES13を用いた治療法では、尿道括約筋層に自家骨格筋細胞を経尿道的に注入します。また、ICEF15と同様に、細胞の投与を併せて電気刺激装置による電気刺激を実施し、投与した細胞の生着を促します。
C)臨床試験の状況
イ)これまでに終了した臨床試験・治験
現在までにICES13を用いた計4本の臨床試験において計669例の患者組入実績があり、このうちSUITE試験を後期第Ⅱ相臨床試験として、INNOVATION試験を第Ⅲ相国際臨床試験として、それぞれ実施いたしました。しかしながら、INNOVATION試験では、臨床試験管理を委託したCRO(臨床試験支援企業)が試験実施中に倒産したため、有効性に関する充分な結論を得ることができませんでした。
ロ)後期第Ⅱ相臨床試験(SUITE試験)の結果
主要エンドポイント(※9)を達成し、臨床的且つ統計的に有意なレベルで腹圧性尿失禁の症状を抑制することが示されました。
⑥ 知的財産権
当社グループが出願した特許のうち、注入機器及び肛門失禁の治療法に関するものが既に成立しております。また、「筋由来の細胞を得る」方法や「骨格筋由来平滑筋細胞」に関する特許も出願しており、いずれも米国及び欧州において特許が成立しています。
なお、現在当社グループが開発しているパイプラインを事業化した際に使用する予定の特許は全てInnovacell GmbH(旧社名名義での権利を含む)が所有あるいは適法に使用許諾を受けた権利です(※)。同社はこれまで実施した他社知財侵害調査(Freedom-to-operate調査)を通じて、当該パイプラインの事業化時期に鑑みたうえで、同社の知的財産権が他社の知的財産権を侵害したり、あるいは他社の知的財産権が同社の知的財産権を侵害したりしておらず、当社グループの3つの研究開発パイプラインを事業化する上で必要な知的財産権が有効であることを確認しています。知的財産権のうち商標権については商号についての商標権を計3件をグループで保有しており、特許権については当社子会社が保有しており、主な特許権の詳細は以下のとおりであります。
・肛門失禁の治療方法(INC-001)(WO 2008/104883)(筋芽細胞を外肛門括約筋に注入することを内容とするもの)(欧州のみで成立)
・筋由来細胞を得る方法(INC-012)(WO 2019/115790)(自家骨格筋由来細胞の製造工程に関するもの)(日米欧で成立)
・誘導平滑筋細胞を得るための方法(INC-014)(WO 2020/193460)(自家骨格筋由来細胞の製造工程に関するもの)(日米欧で成立)
存続期間満了の時期を考慮すると、上記特許の内筋由来細胞を得る方法及び誘導平滑筋細胞を得るための方法が事業運営上より重要性が高いものと考えております。
(※)特許を含む知的財産権の保有状況等については、第2 事業の状況 3事業等のリスク ⑨知的財産権及び職務発明も併せてご参照ください。
<用語解説>
|
番号 |
用語 |
意味・内容 |
|
※1 |
GMP |
GMPとは、Good Manufacturing Practice(適正製造規範)の略で、原材料の受け入れから製造、出荷まで全ての過程において、製品が「安全」に作られ、「一定の品質」が保たれるようにするための製造工程管理基準のことです。 |
|
※2 |
細胞治療 |
細胞治療とは、患者さま自身の細胞(自家)または他人の細胞を(他家/同種)用いて疾患を治療する治療法です。投与された細胞の働きで疾患を治療するもの、投与された細胞が別の細胞に形を変え疾患を治療するものなど、様々な種類の細胞治療があります。 |
|
※3 |
再生医療 |
再生医療とは、わたしたちの細胞が持つ再生力を活用して、傷ついた組織や失われた機能を元通りに戻すことを目的とした医療技術です。また、これまで治療が難しかったケガや病気の治療法へと応用できるよう現在も研究や開発がすすめられています。 |
|
※4 |
ATMP(Advanced Therapy Medicinal Products) |
ATMPとは、遺伝子、ヒト組織、または細胞を基盤とするヒト治療用製品のことであり、欧州医薬品庁の先進医療委員会によって指定されたものを指します。 |
|
※5 |
HCT/P(Human Cells, Tissues, and Cellular and Tissue-based Products) |
HCT/Pとは、ヒト細胞またはヒト組織を含む、またはヒト細胞または組織から成る製品であり、ヒト患者に対して埋植、移植、注入または導入することを目的としたものです。 |
|
※6 |
アンメット・メディカル・ニーズ |
アンメット・メディカル・ニーズとは、有効な治療法が存在しない、または既存の治療法が不十分である疾患に対する医療ニーズのことで、主に重篤な疾患や治療法が見つかっていない希少疾患が代表例ですが、それ以外でも、現在の治療法では患者さまの負担が大きいケース(用量・用法や副作用など)も含まれます。 |
|
※7 |
侵襲性 |
侵襲性とは、医学用語で「身体にとって害のあること」であり、特に身体への害について指すことが多く、手術であれば身体にメスを入れること、薬であれば副作用の可能性も含めた治療法を指します。 |
|
※8 |
治療アルゴリズム |
治療アルゴリズムとは、特定の疾患に対し、どのような治療法が選ばれるかを様々な因子を考慮しながら決定していく判断基準です。通常は学会ごとに定める治療ガイドラインの中で示されます。 |
|
※9 |
エンドポイント |
エンドポイントとは、治験薬/治験製品の有効性や安全性を評価するための「ものさし」となる指標や評価項目のことです。客観性のある項目であることが求められます。特に重要な評価項目を主要評価項目(プライマリーエンドポイント)、それ以外を副次評価項目(セカンダリーエンドポイント)と呼びます。 |
4【関係会社の状況】
|
名称 |
住所 |
資本金 (ユーロ) |
主要な事業の内容 |
議決権の所有割合又は被所有割合 (%) |
関係内容 |
|
(連結子会社) |
|
|
|
|
|
|
Innovacell GmbH(注) |
オーストリア共和国 インスブルック市 |
372,530 |
細胞治療製品の研究開発 |
100.0 |
当社取締役4名による同社取締役の兼任 |
(注)連結財務諸表を作成する目的で、現地会計基準に基づく財務諸表をIFRS(国際財務報告基準)に基づく財務諸表に組み替えております。最近連結会計年度末時点において、当該IFRS(国際財務報告基準)に基づいた連結子会社単体の純資産は債務超過の状況にあり、その金額は3,107,229千円となっております。
5【従業員の状況】
(1)連結会社の状況
|
|
2025年11月30日現在 |
|
|
事業区分 |
従業員数(人) |
|
|
細胞治療・再生医療研究開発事業 |
48 |
(-) |
|
合計 |
|
( |
(注)1.従業員数は就業人員であり、臨時雇用者数(パートタイマー、人材会社等からの派遣社員を含む。)は、最近1年間の平均人員を( )外数で記載しております。
2.当社グループは、細胞治療・再生医療研究開発事業のみの単一セグメントであるため、グループ全体での従業員数を記載しております。
3.従業員数が前連結会計年度末に比べて11名増加しましたのは、主として業容拡大に伴う期中採用によるものであります。
(2)提出会社の状況
|
|
|
|
|
2025年11月30日現在 |
|
従業員数(人) |
平均年齢(歳) |
平均勤続年数(年) |
平均年間給与(円) |
|
|
|
( |
|
|
|
(注)1.従業員数は就業人員であり、臨時雇用者数(パートタイマー、人材会社等からの派遣社員を含む。)は、最近1年間の平均人員を( )外数で記載しております。
2.平均年間給与は、賞与及び基準外賃金を含み、最近1年以内入社者については平均月間給与額の12倍として計算しております。
3.平均勤続年数は、2021年1月の当社の設立以後の勤続年数を記載しております。
4.当社は、細胞治療・再生医療研究開発事業のみの単一セグメントであるため、セグメント情報との関連は記載しておりません。
5.従業員数が前事業年度末に比べて5名増加しましたのは、主として業容拡大に伴う期中採用によるものであります。
(3)労働組合の状況
当社には労働組合はありませんが、労使関係は円満であり、特記すべき事項はありません。
(4) 管理職に占める女性労働者の割合、男性労働者の育児休業取得率及び労働者の男女の賃金の差異
当社は、「女性の職業生活における活躍の推進に関する法律」(平成27年法律第64号)及び「育児休業、介護休業等育児又は家族介護を行う労働者の福祉に関する法律」(平成3年法律第76号)の規定による公表義務の対象ではないため、記載を省略しております。