第二部 【企業情報】
第1 【企業の概況】
1 【主要な経営指標等の推移】
(注) 1.当社は連結財務諸表を作成しておりませんので、連結会計年度に係る主要な経営指標等の推移については記載しておりません。
2.第8期から第10期及び第12期は、創薬事業の基盤構築の研究開発先行投資により、経常損失及び当期純損失となっております。第11期の当期純利益は、当社とエーザイ株式会社が共同で創製した化合物であるCREB-binding protein (CBP) / β-catenin相互作用阻害剤E7386について、臨床におけるPOC(Proof Of Concept:創薬概念の検証)を達成したことによるマイルストン収入によるものです。
3.持分法を適用した場合の投資利益については、関連会社が存在しないため記載しておりません。
4.1株当たり純資産額については優先株主からの払込金額を控除して算定しております。
5.潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、当社株式は非上場であり、期中平均株価が把握できないため記載しておりません。
6.当社は配当を行っておりませんので、1株当たり配当額及び配当性向につきましては、それぞれ記載しておりません。
7.第8期から第10期及び第12期の自己資本利益率については、当期純損失が計上されているため記載しておりません。
8.株価収益率は当社株式が非上場であるため記載しておりません。
9.第8期から第10期については、キャッシュ・フロー計算書を作成していないため、キャッシュ・フローに係る各項目については、記載しておりません。
10.第11期及び第12期の財務諸表については、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、有限責任 あずさ監査法人の監査を受けております。
なお、第8期、第9期、第10期については、「会社計算規則」(平成18年法務省令第13号)の規定に基づき算出した各数値を記載しております。また、当該各数値については、金融商品取引法第193条の2第1項の規定に基づく監査証明を受けておりません。
11.「収益認識に関する会計基準」(企業会計基準第29号 2020年3月31日)等を第11期期首から適用しており、第11期以降に係る主要な経営指標等については、当該会計基準等を適用した後の指標となっております。
12.2024年1月22日に第三者割当増資により、C種優先株式18,750株を新規発行いたしました。
13.2024年2月14日開催の取締役会において、A種優先株式、B種優先株式及びC種優先株式のすべてについて取得することを決議し、2024年3月5日付で自己株式として取得し、対価としてA種優先株式、B種優先株式及びC種優先株式1株につき、それぞれ普通株式1株を交付しております。また、当社が取得したA種優先株式、B種優先株式及びC種優先株式のすべてを同日付で消却しております。なお、2024年3月14日開催の臨時株主総会において、種類株式を発行する旨の定款の定めを廃止しております。
14. 当社は、2024年5月9日付で普通株式1株につき200株の割合で株式分割を行っており、発行済株式総数は、31,354,800株となっております。第11期の期首に株式分割が行われたと仮定して1株当たり純資産額及び1株当たり当期純利益又は1株当たり当期純損失を算定しております。
15. 当社は、2024年5月9日付で普通株式1株につき200株の割合で株式分割を行っております。
そこで、東京証券取引所自主規制法人(現 日本取引所自主規制法人)の引受担当者宛通知「『新規上場申
請のための有価証券報告書(Ⅰの部)』の作成上の留意点について」(平成24年8月21日付東証上審第133
号)に基づき、第8期の期首に当該株式分割が行われたと仮定して算出した場合の1株当たり指標の推移を
参考までに掲げると、以下のとおりとなります。
なお、第8期、第9期及び第10期の数値(1株当たり配当額についてはすべての数値)については、有限責任 あずさ監査法人の監査を受けておりません。
2 【沿革】
当社の前身であるPRISM BioLab株式会社は、ペプチド模倣低分子化合物を用いて新薬を開発することを目指して2006年に設立されました。10年以上にわたる研究開発の結果、臨床候補化合物を見出し、数多くのシード化合物を生み出しています。
また、当社の独自の低分子創薬手法を用いて、これまで創薬が困難とされてきた標的に対して有望な化合物を見出すPepMetics技術(Peptide Mimetics - タンパク質に存在するヘリックス構造及びターン構造を模倣した化合物を開発・合成する独自の技術)を確立してまいりました。
当社の本書提出日までの変遷の概要は以下のとおりです。
(*)Hit化合物:あるスクリーニング系で設定した活性基準を満たすことが見出された化合物
3 【事業の内容】
当社は、これまで創薬が困難とされていた標的(Undruggable Targets)を創薬可能(Druggable)にすることで新たな創薬パラダイムを作り出し、治療法のなかった病気を治療することを目標に、新たな創薬基盤を構築して新薬開発に取り組んでおります。
(1) 当社のビジネスモデル
当社は、独自の創薬基盤技術である「PepMetics技術」を活用した医薬品の研究開発を行い、製薬会社等と提携、共同研究、導出することにより収入を得る創薬事業を展開しております。
当社の事業の系統図は以下のとおりです。(図1)
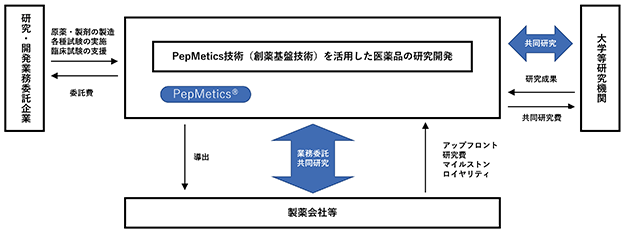
(図1)
PepMetics技術を最大限に活用するために、自社で創薬標的を選定してプログラムを創出する自社開発事業と、大手製薬会社の創薬標的に当社の技術を利用してプログラムを創出する共同開発事業の二つのビジネスモデルを並行して行っております。これにより、限られたリソースで多くの創薬プログラムを生み出すと同時に、技術の発展やノウハウの蓄積の相乗効果も得られます。
自社開発事業における製薬会社との主な提携として、エーザイ株式会社及び大原薬品工業株式会社とのライセンス契約があり、アップフロント、マイルストン、ロイヤリティの収入を得ております。また、共同開発事業では、Merck KGaA社、Boehringer Ingelheim International GmbH社、LES LABORATOIRES SERVIER社、F. Hoffmann-La Roche Ltd.社、Genentech, Inc.社、Eli Lilly and Company社との提携があり、それぞれ創薬標的を定めてHit化合物の探索(*1)を行っております。
自社開発事業では、PepMetics技術に適し、かつアンメットメディカルニーズ(いまだに治療法が見つかっていない疾患に対する医療ニーズ)が高い疾患を治癒する可能性の高い創薬標的を選定し、自社でHit化合物の創出、Hit化合物から臨床候補化合物(*2)への最適化(Optimization)を行い、臨床試験に入るために動物等で確認する非臨床試験を進めながら開発パートナーとなる製薬会社を探し導出いたします。
プログラムを進めるための資金は自社で負担するため、当初は資金面でも人材面でも投資が必要なことに加え、プログラムが途中で中止になるリスクや、製薬会社のパートナーが見つからないリスクがあります。一方で、プログラムの開発が進むほど価値が高まり、導出できた場合に得られる収入(アップフロント、マイルストン、販売後の売上に対するロイヤリティ)は大きくなります。収入は、適用疾患の市場規模、創薬標的の有望性、開発計画の妥当性、競争相手の有無、化合物の有効性や投与方法等、複合的な要素により決まります。
また、自己資金で臨床試験に進める選択肢もあり、投資額は格段に大きくなりリスクも高まりますが、臨床試験で効果が認められれば飛躍的に良い条件で導出できる可能性も高まります。
このように自社開発事業は先行投資を行うハイリスク、ハイリターンのビジネスモデルとなり、成功確率を高めるためには複数のプログラムを持つことが重要になります。当社では、これまで2つのプログラムを日本の製薬会社に導出し、開発の進捗に応じたマイルストンを受け取り、承認されればロイヤリティを受け取ることになっております。現在それに続く新たな3つのプログラムの研究開発を行いつつ、継続的に次の創薬標的の選定を行っております。
共同開発事業では、創薬標的をすでに持っている製薬会社等をパートナーとし、当社のPepMetics技術を活用してHit化合物を創出し、最適化を行います。従来の契約では、最適化はパートナーの意向に応じて共同、もしくはパートナーが単独で行うことになっておりましたが、Eli Lilly and Company社との契約以降は当社がLead化合物もしくは臨床候補化合物までの合成並びに化合物評価を行う契約への転換を図っております。これは、当社内で活性評価の機能を構築したことで可能となったもので、開発効率並びに経済的にも改善が見込まれます。
当社はPepMetics化合物の知財と評価可能なライブラリーを有していることに加え、創薬標的に合わせて化合物を合成する独自の技術、ノウハウを持っており、製薬会社が困難とする創薬標的での創薬が期待されております。
収入は、アップフロント、共同研究収入、開発の進捗に応じたマイルストン及び販売後の売上に対するロイヤリティを受け取ります。それらの収入の総額は、自社開発事業に比較すると小さくなりますが、当社側の投資が少なく初めから収益化が見込めることが特徴となっております。共同開発事業の契約金は、過去の創薬の実績や他の技術では探し出せない創薬標的にHit化合物が創出される期待値、パートナーの開発費予算等の要因から交渉によって決まります。すなわち、実績を積み信頼性が高まるほど期待値が高まり、大きな収入を得られるようになるビジネスモデルであります。今後は年に2件程度の新規契約を目標としてまいります。
PepMetics技術を活用して、ハイリスク、ハイリターンの収益モデルである自社開発事業と、安定的で早期収益化が可能な収益モデルである共同開発事業の二つを組み合わせることで、安定的かつ大きなリターンを目指すことが可能になっております。(図2、図3)

(図2)
※一般的な低分子による新薬開発の流れ:当社ではこのような一般的な新薬開発の流れに沿って、主に化合物最適化までを実施いたします。
(注) 1.上記期間は、一般的な新薬開発の流れをイメージとして示すものであり、実際の開発期間は、様々なリスクや不確実性に左右され、上記期間と大きく異なる可能性があります。
2.臨床試験の各相には、前期(a)、後期(b)が含まれる場合があります。
(図3)
(2) 当社の技術
<PepMetics技術について>
PepMetics技術は、ヘリックス構造(*3)を模倣した低分子有機化合物(*4)によって、細胞内でのタンパク質間相互作用(PPI:Protein-Protein Interaction)(*5)を制御するものです。PepMetics化合物の基本構造は、複数の飽和環状構造(*6)を有する骨格に3個から5個の側鎖(*7)のついた構造で、3次元的に側鎖の位置と方向を制御することで、多種多様なヘリックス構造を高い精度で模倣することが可能となります。
キナーゼ阻害剤に代表されるタンパク質を標的とした従来の低分子による分子標的薬は、小さく深い穴に化合物が入り込むことで強く結合しておりました。ところが、PPIの結合部分のポケットは比較的大きく、従来の手法では十分な結合ができませんでした。
PepMetics化合物は、PPIで最も頻繁に利用されるモチーフであるヘリックス構造のペプチドの一部を模倣する低分子化合物で、比較的大きなポケットに対して複数の接点を確保することで強く結合します。(図4)

(図4)
<細胞内のPPIの重要性>
人の体は複雑に構成、制御され、恒常性を維持し、様々な環境の変化に対応しております。これらは、細胞のレベルで様々なシグナルを発生、伝達、解読し、適切な対応をすることで維持されております。そのためには、多種多様なシグナルを正確に伝えることが必要ですが、その役割を果たしているのがタンパク質(*8)や遺伝子(*9)であります。体内では様々なタンパク質が細胞内外にあってシグナルを伝える役割をしております。シグナルを伝えるタンパク質等が細胞の外にある受容体(*10)に結合することで細胞内のシグナルが起動され、それが細胞内のタンパク質や遺伝子の結合や相互作用の連鎖によって核内に伝えられ、DNA(*11)の適切な部分の情報を読み取ってmRNAを生成し、翻訳機構によって新たなタンパク質が生成されます。
これらのシグナル伝達に重要な役割を果たすのがPPIで、異常をきたすと疾患の原因ともなり、重要な創薬標的となります。(図5)

(図5)
バイオ医薬(タンパク医薬や抗体医薬)(*12)は、分子量が大きい(高分子)ために細胞の中には入らず、細胞の外や受容体の部分でシグナルを制御しております。一般に、細胞の中に伝えられるシグナル経路は、細胞内で複数の役割を果たすことが多く、細胞外で止めることは目的の作用以外の役割も上流で止めてしまうことになり、副作用が生じやすくなります。細胞内でタンパク質同士の結合を選択的に阻害(制御)して目的の作用のみを止めることは、これまで創薬の分野で重要と期待されながらも方法が確立されておりませんでした。
PepMetics技術では、細胞膜を通過できる低分子化合物を用いて、細胞の中に伝えられたシグナルの下流で治療に必要なシグナルだけを止めることが可能となります。(図6)
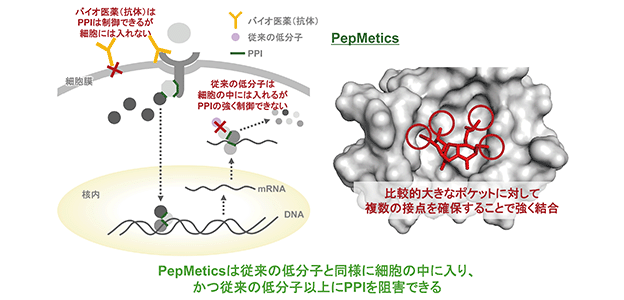
(図6)
《従来の創薬技術(バイオ医薬)、PepMetics技術、従来の低分子の違い》
(a) PepMetics化合物の特徴
従来の人工合成による低分子では、細胞内でのPPIを制御することは困難とされてきました。一方で、天然物をもとにした薬では、細胞内でのPPIを含む様々な効果が認められております。これは、合成による化合物の場合は多様性を確保しやすい合成ルートを用いる結果、平面的な化合物が多くを占めるのに対し、天然物は3次元的、団子状(Globule)の化合物が多くみられる傾向にあるためです。しかし、天然物は合成が極めて困難で、最適化のための化合物改変の余地も限られるため、創薬の成功は偶然性に依存しており、特定のPPIを標的に創薬をすることは困難とされてきました。
PepMetics化合物の特徴を分析するために、承認された低分子医薬品を主成分分析モデル(PCA分析)で2次元平面に分散させ、合成化合物由来の上市医薬品(グレー)と天然物由来の上市医薬品(赤)に分けました。そこに、PepMetics化合物(緑)を重ね合わせたところ、PepMetics化合物は天然物由来の医薬品に近い特徴を持った化合物であることがわかります。(図7)
すなわち、PepMetics化合物は通常の低分子化合物のように合成できる一方で天然物の特徴を持つ化合物群で、そのために従来Undruggableとされてきた創薬標的でも多くのHit化合物を生み出していると考えられます。
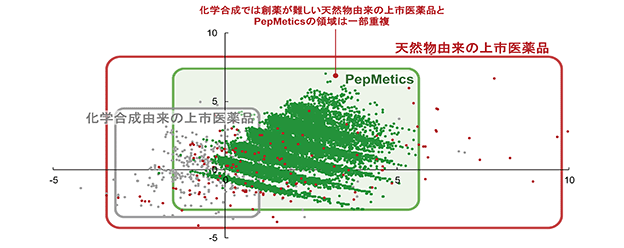
※:論文「Property distributions: differences between drugs, natural products, and molecules from combinatorial chemistry」に記載の方法に従い、2015年10月31日以前に上市された医薬品を基に当社で主成分分析を行いグラフを作成。横軸は第1主成分、縦軸は第2主成分を示す
(図7)
(b) 多様な化合物空間とライブラリーの有用性
体内では様々なPPIが選択的に制御され、特定のタンパク質やペプチドが、特定の相手に結合することでシグナルを正確に伝えております。
この選択性に重要なのがアミノ酸配列と骨格の形状で、PepMetics化合物では40種類の骨格と、天然アミノ酸と非天然アミノ酸を含む50種類以上のアミノ酸側鎖を自由に組み合わせられる技術を開発いたしました。それにより、例えば4つのアミノ酸をつなげたPepMetics化合物の場合、理論的には2億5千万とおり以上の組み合わせの化合物をデザインすることが可能で、当社はそのような化合物をバーチャルライブラリー(V-Library:Virtual Library)として確保しており、その中で、実際に合成を完了して評価することができるライブラリー化合物(R-Library:Real Library)が2万個以上あります。(図8)
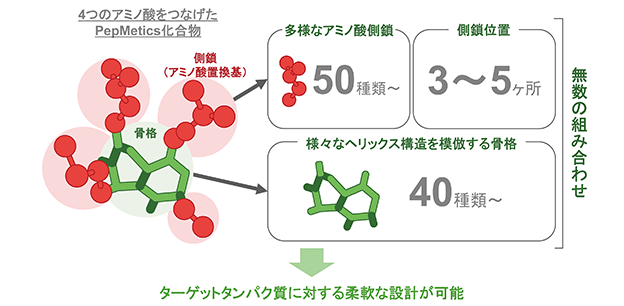
(図8)
これらのライブラリーのバーチャルスクリーニングと実際の細胞等を使った評価を行うことで、効率よくHit化合物を見出し、改良することが可能となると考えております。
(c) 多様な創薬アプローチの開発
当社は、PepMetics技術を多くの創薬標的に活用するために様々なアプローチを開発しました。これにより、製薬会社の多様なニーズに合った研究が進められることになったと考えております。
SBDD アプローチ:
創薬標的のタンパク質同士の結合の様式がX線解析等の手法で明らかになっている場合、構造をもとにした分子設計(SBDD: Structure Based Drug Design)が可能です。標的とするポケットに対して、結合するタンパク(リガンド)がどのように結合するかを分析し、PepMeticsに置き換えて結合力を計算します。この手法で、当社のV-Library、R-Libraryを含む化合物のバーチャルライブラリーのスクリーニングを行い、結合する可能性の高い化合物をR-Libraryから選定、もしくはV-Libraryから選定して合成することでHit化合物を創出いたします。また、ライブラリーにはない化合物もポケットに合わせてデザインし、個別に合成することで成功の確率を高めます。
配列に基づくアプローチ:
標的タンパク質の結合構造がわからない場合には、PepMetics化合物が天然のヘリックス構造を模倣することを利用して、アミノ酸の配列情報から候補化合物を合成し、Hit化合物を探索することも可能です。
PPIを制御するためにランダムに発生された中分子ペプチド、サイクリックペプチド(*13)等を用いて標的に結合するペプチドを探索する手法が活用されております。しかし、見出されたペプチド(バインダー)をそのままで薬にすることは難易度が高く、低分子に置き換えることが期待されております。また、バインダーが標的のタンパク質にどのような様式で結合しているかが解析できれば上記のSBDDが可能になりますが、ペプチドは様々な構造を持ちうるため、結合様式を予測することが困難な場合が多くあります。
PPIで最もよく使われるのはヘリックス構造で、ペプチドのある特定の部分(連続する3~4個のアミノ酸)がヘリックス構造を形成して相手に結合していると推測することができます。そこで、ペプチドの配列情報から、配列の中の連続する3つのアミノ酸を端から一つずつずらしながら模倣するPepMetics化合物を作ることで、結合構造を模倣できる可能性があります。
この方法を用いて、CTLA-4(cytotoxic T-lymphocyte-associated protein 4:免疫チェックポイントタンパク質)という従来の低分子では困難とされる標的に対して、Hit化合物を見出す実例を示すことができました。
ライブラリースクリーニング:
創薬標的についての情報が少ない場合や標的そのものが限定されない場合には、可能性を最大化するためにライブラリー(R-Library)のスクリーニングを行います。これによって、想定している作用に加えて、異なる部分に作用することで同様の効果を生む(アロステリック効果)化合物の探索も可能になります。
体内でのPPIは65万種類あるといわれていますが、その中で知られているのはほんの一部にすぎません。結合に頻繁に使われるヘリックス構造をもち、多様なアミノ酸配列を模倣するPepMetics化合物を活用することで、想定外の結合様式やPPIの作用を見出す可能性もあります。
(3) 当社のパイプライン
当社ではPepMetics技術を活用して、独自のパイプラインの開発を行っております。
(a) Wnt阻害剤(E7386、PRI-724)
Wntシグナル伝達経路(*14)は1980年代に発見され、ガンの細胞「増殖」に関係することが知られており、多くの新薬開発の試みがなされました。
正常細胞が細胞分裂の際に同じ細胞に分裂する「増殖」と異なる機能を持った細胞に分裂する「分化」のバランスをとるのに対し、突然変異によりできたガン細胞は異常に「増殖」を繰り返すことで腫瘍となって肥大化します。Wntシグナルは「増殖」を促進するため、Wntシグナルを阻害すれば、ガンが進行しないと考えられました。ところが、Wntシグナルは細胞が「増殖」する際のみならず、「分化」する際にも重要な機能を果たすため、Wntシグナルを止めることは副作用につながります。従来の技術で開発されたWnt阻害剤は細胞外からシグナルそのものを止めてしまうため、強い毒性を示して開発が中止されてきました。PepMetics化合物は細胞の中に入り込んでWntシグナル伝達経路全体の一部だけを止めることで、Wntシグナル全体を止めずに「増殖」を「分化」に切り替えるスイッチの役割を果たします。
Wntシグナルは、細胞の中でβ-カテニン(*15)というタンパク質を通じて伝達されます。細胞核内でβ-カテニンが、CBP(*16)というタンパク質に結合することで、転写が始まり、「増殖」のスイッチが入ります。PepMetics化合物は、この転写因子であるCBPに結合し、CBPとβ-カテニンの結合を阻害します。その結果、β-カテニンはCBPと似た別なタンパク質P300(*17)と結合し、この結合が細胞を「分化」に導く転写を始めます。すなわち、PepMetics化合物はWntシグナル全体を止めることなく、「増殖」を「分化」に切り替えるスイッチの役割を果たすことが可能です。
また、これまでの実験結果から、Wntシグナル伝達経路はガンのみならず線維症(*18)等の他の疾患分野にも深く関連することが知られており、様々な疾患での創薬に結び付ける開発を進めております。
E7386:
エーザイ株式会社との共同研究で見出された化合物で、当社の研究成果をエーザイ株式会社に導出しました。
エーザイ株式会社により臨床試験を実施しており、2021年11月には臨床試験におけるPOCを達成いたしました。現在、第Ⅱ相臨床試験を実施しており、単剤、レンバチニブとの併用、ペムブロリズマブとの併用試験を実施しております。(図9)

※1:E7386はエーザイと共同創製した化合物
※2:Selected Wnt signaling mutations (based on ctDNA analysis) are shown in blue. BID, twice daily; C#D#, cycle # day #; mRECIST, modified response evaluation criteria in solid tumors; PD, progressive disease; PR, partial response; QD, once daily; SD, stable disease.
出所:American Society of Clinical Oncology(ASCO)年次総会(2023 ASCO Annual Meeting)ポスター発表(2023年6月2~6日)
(図9)
PRI-724:
Wntシグナル伝達経路のCBP/β-カテニンの結合を阻害し、様々な線維症に対する効果が示されております。
2014年から肝硬変患者に対する臨床試験を開始し、2018年に大原薬品工業株式会社に導出しました。国立研究開発法人日本医療研究開発機構(AMED)の医療研究開発革新基盤創成事業(CiCLE)に採択されて臨床試験が進められております。(図10)
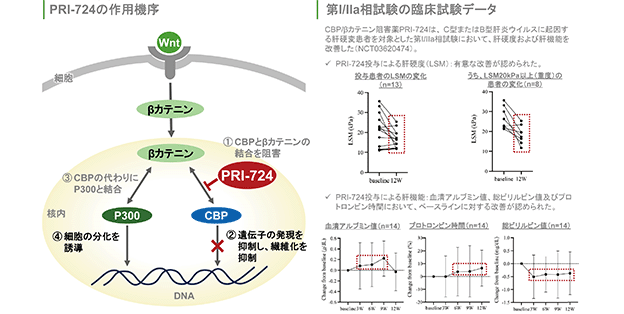
出所:Kiminori Kimura et al. Safety, tolerability, and anti-fibrotic efficacy of the CBP/β-catenin inhibitor PRI-724 in patients with hepatitis C and B virus-induced liver cirrhosis: An investigator-initiated, open-label, non-randomised, multicentre, phase 1/2a study(DOI: 10.1016/j.ebiom.2022.104069)
(図10)
C型肝炎及びB型肝炎による肝硬変患者を対象とする第Ⅰ相及び第Ⅱa相臨床試験は2021年7月に終了し、肝硬度、肝予備能、及び血清アルブミンレベルの統計的に有意な改善が観察されました。これにより、AMEDのCiCLEの中間評価では「PhaseⅡa試験において有効性を確認でき、安全性上の懸念も少ないことから、次相試験の実施が可能と考えられ、今後も計画とおりに進捗することが期待される。」との評価結果を得て、2023年7月よりNASH(非アルコール性脂肪肝炎)による非代償性肝硬変患者も対象に加え、多施設共同プラセボ対照無作為化二重盲検比較臨床試験(PhaseⅡ)が開始されております。
(b) その他自社プログラム : 細胞内の翻訳機構を制御する化合物
その他進行中の自社プログラムのひとつとして、「翻訳」に関わるタンパク質であるeIF4EとeIF4G(*19)の結合を制御する化合物(FEP)の開発を進めております。
ガンに関係する様々な細胞内シグナル伝達経路の終末で作用点であるCAP依存性翻訳複合体(CAP複合体)は、mRNAの情報からタンパク質を生成する役割を持っております。このCAP複合体を構成するeIF4EとeIF4Gの結合を阻害することで、ガンの増殖に必要なタンパク質の合成を止める仕組みです。
本来、この結合を調整する制御因子として4E-BP1というタンパク質がeIF4Eに結合することで過度な翻訳が制御されておりますが、ガン細胞では上流のPI3K/Akt/mTOR経路が活性化され、4E-BP1の機能が無効化されております。そこで、当社はPepMetics技術を用いて4E-BP1の模倣化合物を作り、過度な翻訳を制御することに成功いたしました。
実際にはいくつかのガン種において、この経路が特に活性化されていることが報告されております。たとえばTNBC(トリプルネガティブ乳ガン)では約42%、膀胱ガンでは約43%の患者様において本経路が活性化されており、4E-BP1の模倣化合物はこれらガンに対する分子標的薬として期待されております。アメリカ・日本・ヨーロッパ主要国でのこれら活性化されている対象患者数は、TNBCで約13万人、膀胱ガンで約11万人と見積もることができ(Datamonitor Healthcare® Patient-based market forecastによる)、更にはこれらガン腫に対する分子標的薬が無いことから、マーケット的に大きなインパクトがあります。
一方で従来すすめてきたeIF4E/eIF4G阻害剤に加えて、新たに創薬分子標的の選定を行い、複数のプログラムを進めております。成功確率が著しく低い創薬研究において継続的に新薬を創出するためには、バランスの取れた健全なプログラムポートフォリオの構築が必須となります。また、複数のプログラムを並行して走らせることにより、プログラムをストップする健全な判断がより容易となります。当社は、創薬標的の選定において、Scientific Advisory Board(科学的なアドバイスをする諮問委員会)からの助言を得ることにより成功確度をより高めるよう努めております。
このようにPepMetics化合物を用いることで、これまで制御困難とされてきた創薬が極めて困難な標的に対して様々な創薬プログラムを立ち上げております。(図11、図12)

※1:E7386はエーザイと共同創製した化合物
※2:導出先、共同開発先を含む
※3:化合物開発のために必要な知的財産権の相手による使用を許可すること
(図11)

(注) 上記の情報には、現在入手可能な情報に基づく当社の判断による、将来に関する記述が含まれています。そのため、上記の情報は様々なリスクや不確実性に左右され、実際の開発状況はこれらの見通しとは大きく異なる可能性があります。導出された製品候補については、パートナーが今後の開発・商業化の第一義的な責任を負います。
※1 E7386はエーザイ社との共同創製プログラム
(図12)
(4) 当社の事業の可能性
新薬を作り出す歴史では、技術革新によって新たな創薬手法を生み出すパラダイムシフトが幾度となくあり、その度にそれまで不治とされていた病気に治療方法が生み出されております。天然物を煎じた薬に始まり、19世紀初頭に有効成分のみを抽出する技術によって薬効が高まり、19世紀末に人工的な合成技術によって低分子化合物医薬品(アスピリン)が生まれ、約一世紀にわたって低分子創薬の時代が続きました。20世紀末に高分子のバイオ医薬品(ヒトインスリン)が実用化されたことを皮切りに、抗体医薬品、免疫チェックポイント阻害剤、核酸医薬(mRNA等)等、それまでの常識を覆す技術が発明されることで、医薬品は飛躍的な発展を繰り返してまいりました。また、そのようなパラダイムシフトを牽引したバイオベンチャーは飛躍的に成長し、大手製薬会社と肩を並べる規模に成長しております。(図13)

(図13)
細胞内PPI阻害薬はこれまで一つしか承認されておらず(ベネトクラクス、Abbvie社)、その開発は極めて困難とされてきましたが、PepMetics技術により新たな創薬分野を切り開く可能性を持っていると当社は考えており、そのための技術確立と活用を目指しております。
当社の開拓する細胞内PPI創薬の可能性を示すために、同様に低分子である酵素(キナーゼ)阻害剤との比較を以下に記載いたしました。キナーゼ阻害剤が創薬標的の数や薬のメカニズム(作用機序)、適応症が限定されるのに比べ、細胞内PPI阻害剤はより大きな可能性を持つと考えております。(図14)

出所:※1 Robert Roskoski Jr Properties of FDA-approved small molecule protein kinase inhibitors:
A 2023 update (DOI.org/10.1016/j.phrs.2022.106552)
※2 Douglas R. Green A BH3 Mimetic for Killing Cancer Cells (DOI: 10.1016/j.cell.2016.05.080)
細胞内、細胞外を含む
※3 Datamonitor Healthcare
※4 AbbVie社により見出されたPPI阻害剤。BCL2タンパク質とBAXタンパクのPPIを阻害し、ガン細胞の細胞死を引き起こす事により、抗腫瘍効果を示す (図14)
(5) 当社の優位性
当社でのPepMetics技術は下記の優位性を保持しており、PPIを狙った低分子創薬において競合優位性を保持しております。
(a) 有機合成
当社はPepMetics化合物の特許を取得していることに加え、他社が容易に追随できない合成ノウハウを蓄積しております。これまで3万以上のPepMetics化合物を合成した実績があり、成功例だけでなく失敗例を含めた反応実績を全て社内データベースで容易に参照可能となっております。これにより、天然物様の立体的で複雑な構造を有するPepMetics化合物の合成を、通常の平面来な低分子化合物の合成のように簡便かつ効率的に合成可能とする体制を整えております。
(b) AI
当社では進展著しいAI(人工知能)技術をPepMetics化合物へ応用しております。多様な側鎖のバリエーションが可能な一方で限られた骨格群を有するPepMetics化合物は、無限に空間が広がる通常の製薬会社の低分子化合物よりもAIと相性が良いことが期待できます。この特性を活用し、当社ではPepMetics化合物に特化したADMET(化合物の吸収、分布、代謝、排泄、毒性)のAI予測モデルを構築・実用化しております。自社独自で保有するPepMetics化合物群のデータに基づき、高精度でのAI予測が可能です。自社プログラムや共同プログラムにおいて実績を残しているのみならず、他者が保有できない独自のAI技術として今後のさらなる深化、発展が見込まれます。
<用語解説>
*1 探索
創薬研究の最初の段階として、医薬品の元となる生理活性をもつ物質を探索する研究段階があります。この研究を一般的に探索研究と呼びます。
*2 臨床候補化合物
臨床試験の候補となる化合物です。創薬研究の探索段階において見出した初期化合物を、有効性や安全性など様々な側面から改良し、臨床候補化合物を創出します。
*3 ヘリックス構造
生物学において、タンパク質や核酸といった生体高分子の主鎖の部分的な立体構造を二次構造と言います。ヘリックス構造は、二次構造のうちヘリックス(螺旋)状の構造をとるものです。
*4 低分子有機化合物
分子量の小さい有機化合物です。一般的に分子量が900以下のものを指します。
*5 タンパク質間相互作用(PPI)
複数のタンパク質分子が状態に応じて特異的複合体を形成する現象です。
*6 飽和環状構造
主に有機化学において原子が環状に結合し、かつ単結合のみで構成される構造を飽和環状構造と言います。
*7 側鎖
鎖式化合物の分子構造で、最も長い炭素原子の連鎖(主鎖)から枝分かれしている部分です。
*8 タンパク質
アミノ酸が鎖状に多数連結(重合)してできた高分子化合物であり、生物の重要な構成成分の一つです。ヒトでは20種類のアミノ酸からタンパク質が構成されます。構成するアミノ酸の数や種類、また結合の順序によって種類が異なり、分子量約4千前後のものから、数千万から億単位になるウイルスタンパク質まで多種類が存在します。連結したアミノ酸の個数が少ない場合にはペプチドと言い、これが直線状に連なったものはポリペプチドと呼ばれることが多いです。タンパク質は、炭水化物、脂質と共に三大栄養素と呼ばれ、身体をつくる役割も果たしております。
*9 遺伝子
遺伝子とは人間の体をつくる設計図に相当するものです。ヒトには約2万個の遺伝子があると考えられております。人間の身体は、細胞という基本単位からなっております。この細胞の核と呼ばれる部分に染色体があり、この中のDNAが遺伝子として働いております。人間の身体は、この遺伝子の指令に基づいて維持されております。
*10 受容体
受容体とは、細胞膜表面、細胞質、又は核内に存在し、物理・化学的な刺激を認識して細胞に応答を誘起するタンパク質を言います。受容体は細胞での場所で、以下のように大きく二つに分けられます。
① 核内受容体(細胞内受容体とも言います)
細胞膜を自由に通過できる脂溶性ビタミンA、Dやステロイドホルモンや甲状腺ホルモン等の脂溶性の物質を受容します。これらのリガンド(情報伝達物質)により核内のDNAの特定配列に結合し転写して、必要なタンパク質を合成して生体反応を引き起こします。
② 細胞膜(貫通型)受容体
ペプチドホルモン、細胞伝達物質、増殖因子等の細胞膜を通過できない水溶性の物質を膜表面で受容します。
*11 DNA
DNAはヒトの細胞では、核の中の染色体にあり、A(アデニン)、T(チミン)、G(グアニン)、C(シトシン)の4種類の部品でできております。DNA中ではAとT、GとCが結合していて、その結合の対を塩基対と言います。DNAは、はしごをひねったような形をしていて、核の中の染色体の中に折りたたまれて入っております。DNAを簡単に言うと、私たちの体を作る設計図と言えます。
*12 バイオ医薬
組み換えDNA技術、細胞融合法、細胞大量培養法等のバイオテクノロジーで製造された医薬品。(1)組み換えDNA技術によるたんぱく質性医薬品(ホルモン、酵素、抗体等)、(2)遺伝子治療に用いる遺伝子組み換えウイルス、(3)培養皮膚等の細胞性治療薬、(4)RNAやDNAの断片そのものを用いる核酸性医薬品等です。日本で最初に承認されたバイオ医薬品は、組み換えDNA技術によるヒトインスリン(1985年)。ゲノム科学、ゲノム創薬の進展により、バイオ医薬品の研究開発が国際競争となっております。
*13 中分子ペプチド、サイクリックペプチド
中分子ペプチドは数個から十数個のアミノ酸からなる化合物、サイクリックペプチドは環状構造を持つ化合物で、どちらも新たな創薬モダリティとして注目されています。
*14 Wntシグナル伝達経路
胚発生、ガン、線維化などを制御するタンパク質のネットワークです。創薬標的として広く研究されています。
*15 β-カテニン
核内で他の様々な転写因子と結合して、細胞の増殖あるいは分化に関与する遺伝子の転写を制御します。
*16 CBP
CREBBP(CREB-binding protein、サイクリックAMP反応性エレメント結合タンパク質)とも称される、転写を調節するコアクチベーターとよばれる因子の一つです。βカテニンと結合し、他の多くの転写因子とも協同しながら様々な遺伝子の転写活性を調整します。
*17 P300
CBPと類似の構造・機能をもち、転写を調節するコアクチベーターとよばれる因子の一つです。多くの転写因子と結合して基本転写因子の活性を制御する性質をもつタンパク質です。
*18 線維症
内臓等の組織を構成している結合組織と呼ばれる部分が異常増殖する現象により、たとえば、心筋に線維化が生じたときには心臓の働きに異常が起き、呼吸困難や心悸亢進(動悸)等の症状が出ます。また関節リウマチにおける骨の萎縮や変性、肝臓全体の線維化を示す肝硬変の病態等も、結合組織が線維化した例としてよく知られております。
*19 eIF4E、eIF4G
eIF4E、eIF4GはメッセンジャーRNA(mRNA)に結合して翻訳を調節することで細胞の成長や増殖に関与する因子であり、その過剰発現により細胞のガン化が誘導されることも知られています。ガン細胞はその急速な成長のために通常の細胞に対する成長制御を回避する必要があり、その回避策の一つとしてeIF4E、eIF4Gを過剰に活性化させるなどの方法により、タンパク質合成を制御する仕組みに発ガン性変化を起こさせることが挙げられます。eIF4E、eIF4Gを阻害することでガン細胞の成長促進を妨げるための研究が進められています。
4 【関係会社の状況】
該当事項はございません。
5 【従業員の状況】
(1) 提出会社の状況
(注) 1.従業員数は就業人員であり、臨時雇用者数(パートタイマー、契約社員及び人材会社からの派遣社員を含む。)は、最近1年間の平均人員を〔 〕内に外数で記載しております。
2.平均年間給与は、賞与及び基準外賃金を含んでおります。
3.当社は、創薬事業の単一セグメントであるため、セグメント別の記載を省略しております。
(2) 労働組合の状況
労働組合は結成されておりませんが、労使関係は円満に推移しております。
(3) 管理職に占める女性労働者の割合、男性労働者の育児休業取得率及び労働者の男女の賃金の差異
当社は、「女性の職業生活における活躍の推進に関する法律」(平成27年法律第64号)及び「育児休業、介護休業等育児又は家族介護を行う労働者の福祉に関する法律」(平成3年法律第76号)の規定による公表義務の対象ではないため、記載を省略しております。