第二部【企業情報】
第1【企業の概況】
(はじめに)
当社は、1987年4月に体外診断用医薬品、研究用試薬及び各種分析用試薬の研究開発、中間体の製造を事業として、当社代表取締役社長の野中雅貴の実父である野中浦雄氏が中心となり静岡県沼津市に設立された(株)タウンズを前身としております。
(CITIC(現Trustar) Groupの資本参加前までの変遷)
開発部門の分社化
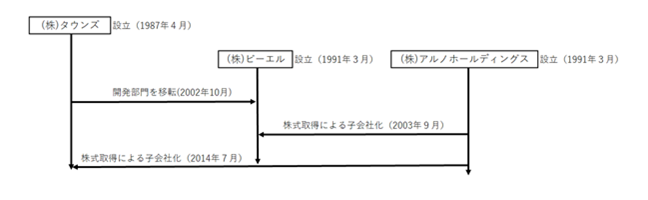
(株)タウンズは、2002年10月に開発部門を(株)ビーエルに移転し、(株)アルノホールディングスを純粋持株会社とする企業グループでの事業運営を実行しておりました。その後、(株)アルノホールディングスは、2003年9月に(株)ビーエル、2014年7月に(株)タウンズの株式をそれぞれ取得し、100%子会社としました。
(株)ビーエルは、当初動物向けの検査薬に特化して開発を行うことを企図して1991年に設立されましたが、2002年に(株)タウンズが製造・販売業に着手するタイミングで(株)タウンズの(ヒト向け検査薬の)開発部門を(株)ビーエルに移転し、それ以降はヒト向けの体外診断用医薬品や研究用検査薬、動物向けの検査薬の基礎研究・開発に特化した会社となりました。設立時の代表取締役は野中浦雄氏であり、当時の取引先は(株)タウンズの他に小林製薬(株)などでありました。
(株)ビーエルは、設立当初は複数の製薬企業から実験動物向けとしてテスタント イヌCRPやテスタント ラット尿中ALBやテスタント マウス 尿中ALBなどの検査薬の開発受託なども請け負い、それぞれに貢献してまいりました。また上述の小林製薬(株)からは食品、化粧品、医薬品などの安全性評価試験を請け負っておりました。
一方、(株)アルノホールディングスに関しましては当初は沼津工業技術センター(現在は沼津工業技術支援センター)らの協力を得ながら温泉浴槽中レジオネラ菌の検査をはじめ、環境ホルモン調査用の研究用試薬の開発などを行っており、設立時の代表取締役は(株)ビーエルに所属していた北川俊之氏でした。上述の2002年における機能再編(旧タウンズは製造・販売へ、ビーエルは開発へ集中)以降、(株)アルノホールディングスは両社を管理するような位置づけへと変わってまいりました。
変遷図は以下のとおりであります。
(CITIC(現Trustar) Groupの資本参加による組織再編)
2016年のCITIC(現Trustar) Groupの当社への資本参加に伴い、以下のとおりの組織再編行為を実施しました。
当社に資本参加したTrustar Groupは、CITIC Groupに属する資産運用会社CITIC Capital Holdings Limited(本社:香港)のプライベートエクイティ部門で、プライベートエクイティファンドの運用、運営業務を行っています。日本企業への投資を行うTrustar Capital 日本ファンドは、日本国内の中堅企業に対して、事業の更なる発展を企図し、Trustar Capitalグループはもとよりグループ外のネットワーク・リソースも活用し、徹底したハンズオン支援を行うことで、企業を活性化させ、企業価値を向上させることを追求しています。なお、Trustar Capital 日本ファンドの前身にあたる、CITIC Capital 日本ファンドは2004年に日本における投資活動を開始し、これまでに製造業・消費財をはじめとした企業への投資を実施しております。
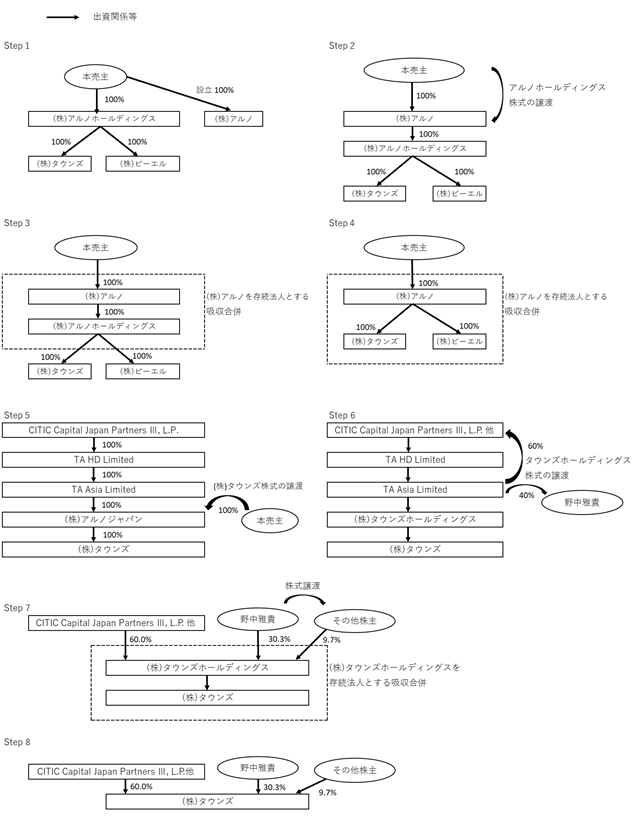
① Step 1
2016年4月19日に、(株)アルノホールディングスの株主であり代表取締役社長の野中雅貴及び他1名(以下、「本売主」という。)が、CITIC Group参画に備えるため既存のグループ会社を整理再編する目的で(株)アルノを金銭出資により設立。
② Step 2
2016年4月19日に、本売主が保有する(株)アルノホールディングス株式の全株式を(株)アルノに譲渡。
③ Step 3
2016年7月1日に、(株)アルノを合併法人(存続法人)、(株)アルノホールディングスを被合併法人(消滅法人)として、(株)アルノと(株)アルノホールディングスが無対価合併を実施。(以下、「本件第一合併」という。)
④ Step 4
上記Step3における本件第一合併実施後、2016年7月1日に、本件第一合併完了を停止条件とする合併契約に基づき、(株)アルノを合併法人(存続法人)、(株)タウンズ及び(株)ビーエルを被合併法人(消滅法人)として(株)アルノと(株)タウンズ及び(株)ビーエルがそれぞれ無対価合併を実行。(以下、「本件第二合併」という。)同日に存続会社である(株)アルノが(株)タウンズに社名変更。
⑤ Step 5
CITIC Groupは、当社グループ参画にあたり、CITIC Capital Japan Partners III, L.P.の100%子会社であるTA HD Limitedの100%子会社のTA Asia Limitedが2016年4月14日に(株)アルノジャパン(現当社)を設立。
上記Step3及びStep4における本件第一合併、本件第二合併実施後、2016年7月1日に本売主が、本件第一合併、本件第二合併の完了を停止条件とする株式譲渡契約に基づき、本売主の保有する(株)タウンズ(同法人の商号変更前は(株)アルノ)の全株式(自己株式を除く野中雅貴の保有比率は69.3%)を(株)アルノジャパン(現当社)に譲渡(以下、「本件株式譲渡」という。)。
(株)アルノジャパンが自己資金のほか、外部からの借入金で(株)タウンズを取得した結果、(株)アルノジャパンの連結財務諸表上に借入金と、投資差額の配分により無形固定資産とのれんが発生。当該借入金は2021年9月までに全額返済し、またのれんにつきましても2019年6月期までに全額償却完了。無形固定資産はその効用が期待される期間にわたって均等償却中。
⑥ Step 6
2016年7月15日にTA Asia Limitedが野中雅貴に(株)アルノジャパン株式の40%を譲渡。
2016年12月18日に(株)アルノジャパンが(株)タウンズホールディングスに社名変更し、その後の2018年6月20日にTA Asia LimitedからCITIC Capital Japan Partners III, L.P.、CCJP III Co-Investment, L.P.(以下、変遷図ではCITIC Capital Japan Partners III, L.P.他)に(株)タウンズホールディングス株式の残り60%を譲渡。
⑦ Step 7
Step6の株式の譲渡後に野中雅貴から本報告書提出日現在の既存株主であるAriake-T1 投資事業有限責任組合、Ariake Secondary Fund I LP、(株)ロコガイド(現(株)くふうカンパニー)、中澤真士氏に対しての株式を譲渡。2021年7月1日に組織を単純化することでガバナンスをより強化するために、(株)タウンズホールディングスを合併法人(存続法人)、(株)タウンズを被合併法人(消滅法人)として、(株)タウンズホールディングスと(株)タウンズが無対価合併を実施。(以下、「本件第三合併」という。)
⑧ Step 8
上記Step7における「本件第三合併」と同日の2021年7月1日に(株)タウンズホールディングスが(株)タウンズに社名変更。
上記の一連の変遷図は以下のとおりであります。
1【主要な経営指標等の推移】
|
回次 |
第4期 |
第5期 |
第6期 |
第7期 |
第8期 |
|
|
決算年月 |
2019年6月 |
2020年6月 |
2021年6月 |
2022年6月 |
2023年6月 |
|
|
売上高 |
(千円) |
|
|
|
|
|
|
経常利益又は経常損失(△) |
(千円) |
|
△ |
△ |
|
|
|
当期純利益又は当期純損失(△) |
(千円) |
|
△ |
△ |
|
|
|
持分法を適用した場合の投資利益 |
(千円) |
|
|
|
|
|
|
資本金 |
(千円) |
|
|
|
|
|
|
発行済株式総数 |
(株) |
|
|
|
|
|
|
純資産額 |
(千円) |
|
|
|
|
|
|
総資産額 |
(千円) |
|
|
|
|
|
|
1株当たり純資産額 |
(円) |
|
|
|
|
|
|
1株当たり配当額 |
(円) |
|
|
|
|
|
|
(うち1株当たり中間配当額) |
( |
( |
( |
( |
( |
|
|
1株当たり当期純利益又は 1株当たり当期純損失(△) |
(円) |
|
△ |
△ |
|
|
|
潜在株式調整後1株当たり 当期純利益 |
(円) |
|
|
|
|
|
|
自己資本比率 |
(%) |
|
|
|
|
|
|
自己資本利益率 |
(%) |
|
△ |
△ |
|
|
|
株価収益率 |
(倍) |
|
|
|
|
|
|
配当性向 |
(%) |
|
|
|
|
|
|
営業活動によるキャッシュ・フロー |
(千円) |
|
|
|
|
△ |
|
投資活動によるキャッシュ・フロー |
(千円) |
|
|
|
△ |
△ |
|
財務活動によるキャッシュ・フロー |
(千円) |
|
|
|
△ |
△ |
|
現金及び現金同等物の期末 残高 |
(千円) |
|
|
|
|
|
|
従業員数 |
(人) |
|
|
|
|
|
|
(外、平均臨時雇用者数) |
( |
( |
( |
( |
( |
|
(注)1.第4期から第6期の持分法を適用した場合の投資利益については、関連会社がないため記載しておりません。
2.第7期及び第8期の持分法を適用した場合の投資利益については、当社が有している関連会社は、利益基準及び利益剰余金基準からみて重要性の乏しい関連会社であるため記載しておりません。
3.第4期から第6期の1株当たり配当額及び配当性向については、配当を実施していないため、記載しておりません。
4.第7期の1株当たり配当額については、特別配当18円が含まれております。
5.第4期、第7期及び第8期の潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、当社株式は非上場であるため、期中平均株価が把握できませんので記載しておりません。
6.第5期及び第6期の潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、当社株式は非上場であるため、期中平均株価が把握できませんので、また、1株当たり当期純損失であるため記載しておりません。
7.株価収益率については、当社株式は非上場であるため、記載しておりません。
8.従業員数は就業人員であり、臨時雇用者数(パートタイマー、人材会社からの派遣社員を含む。)は、年間の平均人員を( )外数で記載しております。
9.主要な経営指標等のうち、第4期から第6期については、「会社計算規則」(平成18年法務省令第13号)の規定に基づき算出した各数値を記載しており、金融商品取引法第193条の2第1項の規定に基づくEY新日本有限責任監査法人の監査を受けておりません。
10.第7期及び第8期の財務諸表については、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、EY新日本有限責任監査法人により監査を受けております。
11.当社は、第7期において、連結子会社であった(株)タウンズを吸収合併しており、第4期から第6期は、当社は純粋持株会社であり実質的な事業活動を行っていないため、売上高を計上しておりません。
12.第7期の期首から「収益認識に関する会計基準」(企業会計基準第29号 2020年3月31日)等を適用しており、第7期以降に係る主要な経営指標等については、当該会計基準等を適用した後の指標等となっております。
(参考情報)
(はじめに)に記載のとおり、2021年7月1日に当社の連結子会社である(株)タウンズを吸収合併しており、連結子会社の(株)タウンズの業務を主たる業務として継続して行っているため、参考として、第4期から第6期においては、我が国において一般に公正妥当と認められる企業会計の基準に基づいて作成された(株)タウンズホールディングス(現当社)の主要な連結経営指標等を記載いたします。
|
回次 |
第4期 |
第5期 |
第6期 |
|
|
決算年月 |
2019年6月 |
2020年6月 |
2021年6月 |
|
|
売上高 |
(千円) |
4,708,742 |
4,121,609 |
5,906,350 |
|
経常利益又は経常損失(△) |
(千円) |
△1,120,784 |
733,925 |
1,169,651 |
|
親会社株主に帰属する当期純利益又は親会社株主に帰属する当期純損失(△) |
(千円) |
△1,284,863 |
316,090 |
881,418 |
|
包括利益 |
(千円) |
△1,285,201 |
316,327 |
881,918 |
|
純資産額 |
(千円) |
432,741 |
749,068 |
1,630,987 |
|
総資産額 |
(千円) |
9,349,680 |
9,194,078 |
12,187,853 |
|
1株当たり純資産額 |
(円) |
4.25 |
7.41 |
16.23 |
|
1株当たり当期純利益又は 1株当たり当期純損失(△) |
(円) |
△12.85 |
3.16 |
8.81 |
|
潜在株式調整後1株当たり 当期純利益 |
(円) |
- |
- |
- |
|
自己資本比率 |
(%) |
4.5 |
8.1 |
13.3 |
|
自己資本利益率 |
(%) |
△120.2 |
54.2 |
74.6 |
|
株価収益率 |
(倍) |
- |
- |
- |
|
営業活動によるキャッシュ・フロー |
(千円) |
597,105 |
770,628 |
457,247 |
|
投資活動によるキャッシュ・フロー |
(千円) |
△447,578 |
△694,270 |
△824,193 |
|
財務活動によるキャッシュ・フロー |
(千円) |
△292,612 |
△300,000 |
860,000 |
|
現金及び現金同等物の期末 残高 |
(千円) |
1,723,374 |
1,499,548 |
1,992,602 |
|
従業員数 |
(人) |
132 |
148 |
177 |
|
(外、平均臨時雇用者数) |
(95) |
(87) |
(86) |
|
(注)1.第4期の潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、当社株式は非上場であるため、期中平均株価が把握できませんので、また、1株当たり当期純損失であるため記載しておりません。
2.第5期及び第6期の潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、当社株式は非上場であるため、期中平均株価が把握できませんので記載しておりません。
3.株価収益率については、当社株式は非上場であるため、記載しておりません。
4.従業員数は就業人員であり、臨時雇用者数(パートタイマー、人材会社からの派遣社員を含む。)は、年間の平均人員を( )外数で記載しております。
5.主要な経営指標等のうち、第4期から第6期については、「会社計算規則」(平成18年法務省令第13号)の規定に基づき算出した各数値を記載しており、金融商品取引法第193条の2第1項の規定に基づくEY新日本有限責任監査法人の監査を受けておりません。
2【沿革】
|
年月 |
概要 |
|
1987年4月 |
体外診断用医薬品※1、研究用試薬及び各種分析用試薬の研究開発、中間体の製造を事業として、 (株)タウンズを静岡県沼津市に設立 |
|
1991年3月 |
(株)アルノホールディングスを設立 |
|
1991年3月 |
(株)ビーエルを設立 |
|
1994年4月 |
静岡県沼津市小諏訪に本社社屋を新築 |
|
2001年2月 |
静岡県沼津市小諏訪に診断薬工場「ぬまづ工場」を新築 |
|
2001年6月 |
結核菌群抗原検査キット※2「キャピリア®TB」を発売 |
|
2001年10月 |
インフルエンザウイルス抗原検査キット※3「キャピリア®Flu A、キャピリア®Flu B、 キャピリア®Flu A+B」を発売 |
|
2002年10月 |
開発部門を(株)ビーエルに移転 |
|
2003年6月 |
アデノウイルス抗原検査キット※4「キャピリア®アデノ」を発売 |
|
2007年2月 |
白金―金コロイド粒子物質・製法特許取得(注) |
|
2007年8月 |
静岡県沼津市双葉町に本社社屋を新築 |
|
2008年6月 |
白金-金コロイドを利用したアデノウイルス抗原検査キット「イムノエース®アデノ」を発売 |
|
2008年9月 |
インフルエンザウイルス抗原検査キット「イムノエース®Flu」を発売 |
|
2011年8月 |
肺MAC症抗体検査キット※5「キャピリア®MAC抗体 ELISA」を発売 |
|
2012年5月 |
静岡県伊豆の国市に「神島工場」を新設 |
|
2012年7月 |
静岡県伊豆の国市に本社を移転 |
|
2012年7月 |
ISO13485認証取得※6 |
|
2012年10月 |
RSウイルス抗原検査キット※7「イムノエース®RSV Neo」を発売 |
|
2013年3月 |
A群β溶血連鎖球菌抗原検査キット※8「イムノエース®Strep A」を発売 |
|
2015年11月 |
マイコプラズマ抗原検査キット※9「イムノエース®マイコプラズマ」を発売 |
|
2016年1月 |
ヒトメタニューモウイルス(hMPV)抗原検査キット※10「イムノエース®hMPV」を発売 |
|
2016年4月 |
(株)アルノジャパンを設立し、CITIC(現Trustar) Groupが資本参加 |
|
2016年4月 |
(株)アルノを設立 |
|
2016年7月 |
(株)アルノが(株)アルノホールディングスを吸収合併 |
|
2016年7月 |
(株)アルノ、(株)タウンズ、(株)ビーエルの3社が(株)アルノを存続会社とする合併を行い、 社名を(株)タウンズに変更 |
|
2016年7月 |
(株)アルノジャパンが(株)タウンズ株式を取得し、完全子会社化 |
|
2016年12月 |
(株)アルノジャパンが社名を(株)タウンズホールディングスに変更 |
|
2020年4月 |
業容拡大に伴い静岡県駿東郡清水町に清水町事業所(R&Dセンター)を開設 |
|
2020年10月 |
新型コロナウイルス(SARS-CoV-2)抗原検査キット※11「イムノエース®SARS-CoV-2」を発売 |
|
2020年11月 |
ノロウイルス抗原検査キット※12「イムノエース®ノロ」を発売 |
|
2021年7月 |
(株)タウンズホールディングスが(株)タウンズを吸収合併し、社名を(株)タウンズに変更 |
|
2021年11月 |
新型コロナウイルス(SARS-CoV-2)抗原検査キット「イムノエース®SARS-CoV-2 Ⅱ」を発売 |
|
2022年4月 |
唾液を適用検体種とする新型コロナウイルス(SARS-CoV-2)抗原検査キット「イムノエース®SARS-CoV-2 Saliva」を発売 |
|
2022年6月 |
A群β溶血連鎖球菌抗原検査キット「イムノエース®Strep A Neo(Type A)」を発売 |
|
2022年8月 |
SARS-CoV-2抗原/インフルエンザウイルス抗原の同時検出キット「イムノエース®SARS-CoV-2/Flu」 を発売 |
|
2023年4月 |
亜鉛キット※13「アキュリード®亜鉛」、汎用分光光度分析装置※14「アキュリード®」を発売 |
(注)本特許は、2024年2月を以て特許期間が満了しております。
[用語集]
※1 体外診断用医薬品:人に由来する試料(血液、体液、尿、便など)を検体とし、検体中の物質等を検出又は測定することにより、疾病の診断を補助する検査薬であり、厚生労働省より認証や承認を受け、臨床的有用性が認められた製品として市場に販売できること、保険適用の対象となるものと定義されます。一方、研究用試薬は厚生労働省より認証や承認を受けておらず、保険適用は非対象であり、研究を目的とした検査薬となります。
※2 結核菌群抗原検査キット:当社のキャピリア®TB Neoは、結核菌群が菌体外に分泌するタンパク質であるMPT64を検出する体外診断用医薬品です。患者より採取された喀痰を培養した後に、その培養液を用いて検査をします。
※3 インフルエンザウイルス抗原検査キット:インフルエンザウイルスにより引き起こされる代表的な呼吸器疾患の1つです。ヒトに感染するインフルエンザウイルスはA型、B型、C型の3種類があり、重篤な呼吸器症状を表すのはA型とB型になります。
当社のイムノエース®Fluは、抗原検出用キットとして、鼻腔や咽頭からの分泌液中のインフルエンザウイルスのA型とB型の抗原を検出する体外診断用医薬品です。キット付属のスワブ(綿棒)により、患者から採取した検体を用いて検査します。
※4 アデノウイルス抗原検査キット:アデノウイルスは、50以上の多くの血清型があることが知られ、咽頭結膜熱(プール熱)や流行性角結膜炎、感染性胃腸炎などに関与しているウイルスです。
当社のイムノエース®アデノは、咽頭結膜熱や流行性角結膜炎の診断補助に役立てられており、呼吸器疾患だけでなく、眼科領域でも幅広く利用されています。呼吸器症状を呈している場合は咽頭から、眼症状を呈している場合は角結膜から、キット付属のスワブ(綿棒)により採取された検体を用いて検査します。
※5 肺MAC症抗体検査キット:肺MAC症は、非結核性抗酸菌の1種であるMAC(Mycobacterium Avium Complex)菌により引き起こされる肺疾患です。結核症が減少傾向にある中、非結核性抗酸菌症は増加傾向にあります。結核症と類似の症状を呈しますが、治療方法と感染症法上の扱いが異なるため、各種検査により結核菌との鑑別が必要になります。
当社のキャピリア®MAC抗体 ELISAは、患者より採取された血清を検体として、血中に存在するMAC菌に対する抗体(抗GPL-core抗体)を検出することにより、MAC菌の感染有無を検出する体外診断用医薬品です。
※6 ISO13485:医療機器や体外診断用医薬品の品質保証のための国際標準規格です。
『Medical devices-Quality management systems-Requirements for regulatory purposes』(医療機器-品質マネジメントシステム-規制目的のための要求事項)と題されています。
海外向け販売においては、製造販売元として当社に必ず求められる規格でもあります。
※7 RSウイルス抗原検査キット:Respiratory syncytial virus(RSV)は年齢を問わず、生涯にわたり感染を起こしますが、特に乳幼児期において非常に重要な病原体であり、生後数週から数か月の期間に最も重篤な症状を引き起こします。また、患者の多くは乳幼児、小児であり、症状はインフルエンザと類似しており、適切な治療と感染防止のためには必要な検査が求められます。
当社のイムノエース®RSV Neoは、鼻腔の分泌液中のRSV抗原を検出する体外診断用医薬品です。キット付属のスワブ(綿棒)により、患者から採取した検体を用いて検査します。また鼻腔内に滞留する分泌液(鼻汁)を吸引して取得した鼻腔吸引液を検体として検査することもできます。
※8 A群β溶血連鎖球菌抗原検査キット:A群β溶血連鎖球菌は、Strep Aとも呼ばれ、上気道炎や化膿性皮膚感染症などの原因菌として多彩な臨床症状を引き起こします。一般的な疾患は咽頭炎であり、その患者の多くは小児ですが、一方、劇症型溶血性連鎖球菌感染症は、咽頭炎に比べて患者数は圧倒的に少ないのですが、子供から大人まで広範囲の年齢層に発症します。
当社のイムノエース®Strep A Neoは、咽頭の分泌液中のStrep.A菌抗原を検出する体外診断用医薬品です。キット付属のスワブ(綿棒)により、上気道炎や咽頭炎を呈した患者から採取した検体を用いて検査します。
※9 マイコプラズマ抗原検査キット:Mycoplasma pneumoniaeという微生物が原因で引き起こす呼吸器感染症です。他の呼吸器症状と類似することが多く、診断が遅延することでマイコプラズマ肺炎を引き起こすことがあります。マイコプラズマ感染症には適切な抗菌薬の投与が必要であり、疑わしい場合は検査することが重要です。
当社のイムノエース®マイコプラズマは、キット付属のスワブ(綿棒)により咽頭後壁を擦過した検体中のマイコプラズマニューモニエ抗原を検出する体外診断用医薬品です。
※10 ヒトメタニューモウイルス(hMPV)抗原検査キット:2001年に急性呼吸器感染症を引き起こす新しいウイルスとして発見されました。患者の多くは小児であり、インフルエンザやRSウイルスと類似の症状を示すことが知られているため、適切な診療のために原因となる病気の鑑別が求められていました。
当社のイムノエース®hMPVは、鼻腔の分泌液中のhMPV抗原を検出する体外診断用医薬品です。キット付属のスワブ(綿棒)により、患者から採取した検体を用いて検査します。また鼻腔内に滞留する分泌液(鼻汁)を吸引して取得した鼻腔吸引液を検体として検査することもできます。
※11 新型コロナウイルス(SARS-CoV-2)抗原検査キット:新型コロナウイルスは、2019年12月、中華人民共和国湖北省武漢市において確認され、2020年1月30日、世界保健機関(WHO)により「国際的に懸念される公衆衛生上の緊急事態(PHEIC)」を宣言され、同年3月11日にはパンデミック(世界的な大流行)の状態にあると表明されました。SARS-CoV-2による新しいウイルス感染症であり、新型コロナウイルス感染症は、世界各地に広がった重篤な呼吸器疾患になることが知られる感染症です。
現在は、遺伝子検査や抗原検査、抗体検査など幅広い検査試薬が流通しており、より精度の高い検査試薬が望まれています。当社のイムノエース®SARS-CoV-2は、キット付属のスワブにより鼻腔からの擦過した検体を使用しており、体外診断用医薬品として2020年10月より抗原定性検査キットとして販売を開始しました。
※12 ノロウイルス抗原検査キット:感染性胃腸炎を引き起こす原因となる代表的なウイルスの1つです。感染原因は食品だけでなく、看病している方などは糞口感染を引き押すことがあります。少ないウイルスでも発症することが知られ、主に冬季を中心に流行するため、発症早期に検査をすることは、適切な治療や感染防止対策による二次感染や集団感染を引き起こすリスクを軽減することができます。
当社のイムノエース®ノロは患者の糞便や直腸から採取した検体を用いて抗原検出をする体外診断用医薬品です。
※13 亜鉛キット:亜鉛は生体内に広く分布し、多くの酵素の重要な構成成分として存在しています。そのため、亜鉛欠乏の検出は疾患の治療に結び付く重要な情報の1つとなります。当社が開発したアキュリード®亜鉛は、患者より採取された血清又は血漿を検体として、専用試薬と小型の測定機を用い、クリニック等の医療現場において、患者血液中の亜鉛濃度を簡便に測定することができる体外診断用医薬品です。
※14 汎用分光光度分析装置:比色法など反応の結果、反応液の色調変化を測定するための装置であります。従来はこのような分析は、据え置き型の分析装置が使用されており、研究室や検査室などに設置される装置です。当社のアキュリード®(汎用分光光度分析装置)は、小型で持ち運びが可能な装置であり、上述のアキュリード®亜鉛検査の実施の実施を目的に開発された医療機器です。
3【事業の内容】
当社は感染症臨床検査用の抗原検査キットメーカーとして、創業以来30年以上の長きにわたり、さまざまな分析技術を応用した体外診断用医薬品等を製造し、国内を中心として海外にも販売しております。高品質な製品と顧客サービスを提供する企業として、医薬品卸売販売業者を通じてエンドユーザーとして病院及び開業医のみならず、WHOなどの国際機関、研究機関やバイオベンチャー企業などにも製品を提供し、事業活動を行っております。
当社は、体外診断用医薬品事業の単一セグメントであるため、セグメント別の記載を省略しております。
当社主力製品は、イムノクロマト法※を利用することで、特別な装置を必要とせず患者のそばで迅速な診断を可能な抗原検査キットです。他の検査手法としては例えばPCR検査が挙げられますが、PCR検査は検出する対象が核酸であるため、イムノクロマト法を利用した抗原検査キットの検出対象であるウイルスタンパク質とは性質が異なり、また検査の特性・目的も異なります。判定時間・手技の簡易さ・検査コストなどの観点から、当社は感染症検査のマーケットのニーズには、イムノクロマト法を利用した製品がより適していると考えております。
※ イムノクロマト法:この方法を利用した代表的な検査薬としては、薬局などで広く販売されている妊娠診断薬が挙げられます。この検査法のおおまかな原理は、以下のとおりになります。①テストプレートの試料滴下部に検体を滴下すると、検体はテストストリップへ浸透します。検体中の標的抗原は、コロイド等に標識された標識抗体との反応が始まります。この標識抗体は、標的抗原に対して特異的に結合する抗体を使用しています。②標的抗原と標識抗体を含む溶液はメンブレン内を毛細管現象により展開しながら、さらに標的抗原と標識抗体との反応が進みます。③標識抗体と反応した標的抗原の複合体は、メンブレン上に固定化された抗体(判定ライン)と標的抗原が反応し標識抗体と標的抗原の複合体が捕捉されます。この結果、判定ライン上に標識物が集積しラインとして目視判定が可能となります。④標的抗原と反応しなかった標識抗体は、標識抗体認識抗体(コントロールライン)と反応し、標識物が集積しラインとして目視判定が可能となり、検査が正常に機能したことを示します。陽性であれば2本のライン、陰性であれば1本のラインが出現、出現したラインを目視で確認するだけの簡便な検査法です。
<イムノクロマト法の原理>
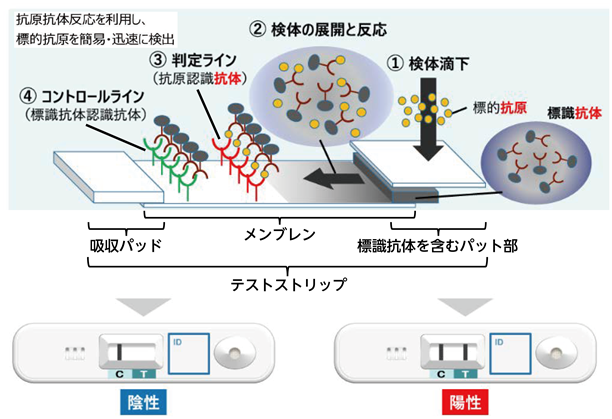
※ 各部の名称:テストストリップは標識抗体を含むパット部から吸収パッドまですべての部材を含むものを指しています。①検体滴下部では、滴下した標的抗原と抗体が結合する反応が起こります。メンブレンは図中のとおり、検体と標識抗体が展開される部位を指します。また、図の下段で示しているとおり、図①~④の一連の反応が起こるテストストリップはプラスチック製のカバーで覆われますが、これらを総合してテストプレートと呼びます。
当社の製品の特長としては、以下の事項が挙げられます。
|
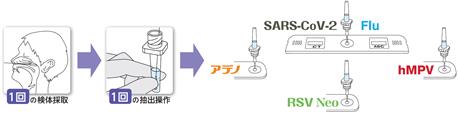
検体抽出液の共通使用 |
検体抽出液はイムノエース®SARS-CoV-2 Ⅱ・SARS-CoV-2/Flu・Flu・アデノ・hMPV・RSV Neo・Flu/RSVで共通使用が可能 |
|
|
|
|
|
検体抽出液の共通化の大きなメリットは、1回の検体採取、1回の抽出操作で、複数項目を検査できる点にあります。新型コロナウイルスやインフルエンザ等の感染症の診断においては鼻咽頭ぬぐい検体が使用されますが、検体採取において鼻咽頭部(鼻腔の最奥)までスワブを挿入する必要があり、軽微ながらも痛みを伴うことがあります。検体採取を一度で完了させることができることは、被検者と医療従事者双方において検体採取における負担が軽減され、また業務効率の観点からも有益であると考えております。 |
|
ブラックライン |
独自開発のナノテクノロジー「白金-金コロイド」採用により判定ライン・コントロールラインを視認性の高いブラックラインで表示 |
|
|
|
|
|
他社イムノクロマト法製品においては、標識物が金コロイド粒子又はカラーラテックスが主流となっておりますが、当社は独自の白金―金コロイド粒子を用いております。当社技術の白金―金コロイド粒子を用いると判定ラインは黒色となりますが、金コロイド粒子では赤紫色、カラーラテックスでは主に赤色と青色となります。従来技術の色調と比較し、当該技術を用いた黒色のラインは背景となるメンブレンの白色とのコントラスト差が大きくなるため、判定ラインの視認性が高くなると考えております。 |
ユーザーからは、当社製品の使用感として、①独自のブラックラインを用いた判定ラインの見易さ(視認性)、②診断の正確性(感度・特異度)、③キットに同梱されている綿棒(コパン社製)の使いやすさと患者に対する侵襲性の低さ、④高感度を保った上での判定時間の短さ、が主に評価され、これらの理由から当社製品を選択頂いているケースが多いものと認識しております。
当社の主な製品は、以下のとおりであります。
|
製品名 |
一般的名称 |
製品の特長 |
|
イムノエース®Flu |
インフルエンザウイルス抗原検査キット |
・判定時間※は5分(陽性は3分から判定が可能) ・判定ラインはブラックライン ・ナイロン軸で植毛タイプの滅菌済み鼻腔用スワブを採用 ・検体抽出液(鼻咽頭ぬぐい液)はイムノエース®SARS-CoV-2 Ⅱ・(鼻咽頭ぬぐい液)・アデノ・hMPV・RSV Neoと共通使用が可能 |
|
イムノエース®SARS-CoV-2 Ⅱ |
新型コロナウイルス抗原検査キット |
・判定時間は15分(陽性は15分より前でも判定部[T]及び[C]の両方にラインが認められた場合には判定可能) ・判定ラインはブラックライン ・ナイロン軸で植毛タイプの滅菌済み鼻腔用スワブを採用 ・検体抽出液(鼻咽頭ぬぐい液)はイムノエース® SARS-CoV-2/Flu・Flu・アデノ・hMPV・RSV Neoと共通使用が可能 |
|
イムノエース®SARS-CoV-2 Saliva |
新型コロナウイルス抗原検査キット |
・唾液を検体とした抗原定性検査キット ・判定時間は20分(陽性は20分より前でも判定部[T]及び[C]の両方にラインが認められた場合には判定可能) ・スワブによる侵襲がなく、くしゃみによる飛沫発生もない ・新型コロナウイルス抗原を20分で検出(陽性は20分より前でも判定部[T]及び[C]の両方にラインが認められた場合には判定可能) |
|
イムノエース®SARS-CoV-2/Flu |
新型コロナウイルス抗原検査キット インフルエンザウイルス抗原検査キット |
・SARS-CoV-2とFluを同時に検査 ・判定時間は15分(陽性は15分より前でも判定部[T]又は[A]又は[B]及び[C]の両方にラインが認められた場合には判定可能) ・判定ラインはブラックライン ・ナイロン軸で植毛タイプの滅菌済み鼻腔用スワブを採用 ・検体抽出液(鼻咽頭ぬぐい液)はイムノエース® SARS-CoV-2・Flu・アデノ・hMPV・RSV Neoと共通使用が可能 |
|
イムノエース®アデノ |
アデノウイルス抗原検査キット |
・判定時間は5分(陽性は3分から判定が可能) ・判定ラインはブラックライン ・ナイロン軸で植毛タイプの滅菌済み咽頭・角結膜用スワブを採用 ・検体抽出液(鼻咽頭ぬぐい液)はイムノエース® SARS-CoV-2・SARS-CoV-2/Flu・Flu・hMPV・RSV Neoと共通使用が可能 |
|
イムノエース® Strep A Neo |
A群β溶血連鎖球菌抗原検査キット |
・判定時間は5分 ・判定ラインはブラックライン ・ナイロン軸で植毛タイプの滅菌済み咽頭・角結膜用スワブを採用 |
|
イムノエース® hMPV |
ヒトメタニューモウイルス抗原検査キット |
・判定時間は5分(陽性は3分から判定が可能) ・判定ラインはブラックライン ・ナイロン軸で植毛タイプの滅菌済み鼻腔用スワブを採用 ・検体抽出液は(鼻咽頭ぬぐい液)はイムノエース® SARS-CoV-2・SARS-CoV-2/Flu・Flu・アデノ・RSV Neoと共通使用が可能 |
|
イムノエース®マイコプラズマ |
マイコプラズマ抗原検査キット |
・判定時間は15分(陽性は5分から判定が可能) ・判定ラインはブラックライン ・ナイロン軸で植毛タイプの滅菌済み咽頭・角結膜用スワブを採用 ・取り違い防止のため、アルミシールにMycoと印字し、紫に着色した検体抽出液容器(本体及びノズル)を採用 |
|
イムノエース® RSV Neo |
RSウイルス抗原検査キット |
・判定時間は5分(陽性は3分から判定が可能) ・判定ラインはブラックライン ・ナイロン軸で植毛タイプの滅菌済み鼻腔用スワブを採用 ・検体抽出液(鼻咽頭ぬぐい液)はイムノエース® SARS-CoV-2・SARS-CoV-2/Flu・Flu・アデノ・hMPV・RSV Neoと共通使用が可能 |
|
イムノエース®ノロ |
ノロウイルス抗原検査キット |
・判定時間は10~15分 ・判定ラインはブラックライン ・滅菌済みスポンジスワブを採用 ・検体抽出液容器の取り違い防止(検体抽出液容器・ノズルを淡橙に着色)を採用 ・スワブ輸送用チューブを付属 |
※ 判定時間:各キットで定められた陽性・陰性判定を実施する時間のこと。通常、抗原検査キットにおいては陰性であることを確認(判定)することで本検査を終了しております。キットによっては判定時間まで待つことなく陽性判定を行うことができ、このような場合は判定時間に関わらず陽性判定できます。
[事業系統図]
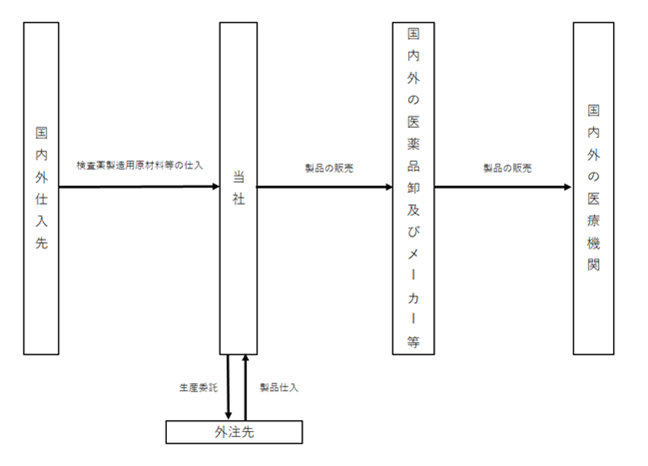
4【関係会社の状況】
当社は関連会社3社を有していますが、重要性が乏しいため記載を省略しております。
5【従業員の状況】
(1)提出会社の状況
|
|
|
|
|
2024年4月30日現在 |
|
従業員数(人) |
平均年齢(歳) |
平均勤続年数(年) |
平均年間給与(円) |
|
|
|
( |
|
|
|
(注)1.従業員数は就業人員であり、臨時雇用者数(パートタイマー、人材会社からの派遣社員を含む。)は、最近1年間の平均人員を( )外数で記載しております。
2.平均年間給与は、臨時雇用者を除く従業員の給与であり、賞与及び基準外賃金を含んでおります。
3.当社は、体外診断用医薬品事業の単一セグメントであるため、セグメント別の記載を省略しております。
(2)労働組合の状況
当社において労働組合は結成されておりませんが、労使関係は円満に推移しております。
(3)管理職に占める女性労働者の割合、男性労働者の育児休業取得率及び労働者の男女の賃金の差異
|
最近事業年度 |
補足説明 |
||||
|
管理職に占める女性労働者の割合(%) (注)1. |
男性労働者の育児休業取得率(%) (注)2. |
労働者の男女の賃金の差異(%) (注)1. |
|||
|
全労働者 |
うち正規雇用労働者 |
うちパート・有期労働者 |
|||
|
20.0 |
100.0 |
56.0 |
70.5 |
57.4 |
- |
(注)1.「女性の職業生活における活躍の推進に関する法律」(平成27年法律第64号)の規定に基づき算出したものであります。
2.「育児休業、介護休業等育児又は家族介護を行う労働者の福祉に関する法律」(平成3年法律第76号)の規定に基づき、「育児休業、介護休業等育児又は家族介護を行う労働者の福祉に関する法律施行規則」(平成3年労働省令第25号)第71条の4第1号における育児休業等の取得割合を算出したものであります。