第二部【企業情報】
第1【企業の概況】
1【主要な経営指標等の推移】
|
回次 |
第2期 |
第3期 |
第4期 |
第5期 |
第6期 |
|
|
決算年月 |
2019年8月 |
2020年8月 |
2021年8月 |
2022年8月 |
2023年8月 |
|
|
事業収益 |
(千円) |
|
|
|
|
|
|
経常利益又は経常損失(△) |
(千円) |
△ |
△ |
△ |
△ |
|
|
当期純利益又は当期純損失(△) |
(千円) |
△ |
△ |
△ |
△ |
|
|
持分法を適用した場合の 投資利益 |
(千円) |
|
|
|
|
|
|
資本金 |
(千円) |
|
|
|
|
|
|
発行済株式総数 |
(株) |
|
|
|
|
|
|
普通株式 |
|
|
|
|
|
|
|
第1回A種種類株式 |
|
|
|
|
|
|
|
第2回A種種類株式 |
|
|
|
|
|
|
|
B種種類株式 |
|
|
|
|
|
|
|
第1回C種種類株式 |
|
|
|
|
|
|
|
第2回C種種類株式 |
|
|
|
|
|
|
|
D種種類株式 |
|
|
|
|
|
|
|
純資産額 |
(千円) |
|
|
|
|
|
|
総資産額 |
(千円) |
|
|
|
|
|
|
1株当たり純資産額 |
(円) |
△ |
△ |
△ |
△ |
|
|
1株当たり配当額 |
(円) |
|
|
|
|
|
|
(うち1株当たり中間配当額) |
( |
( |
( |
( |
( |
|
|
1株当たり当期純利益又は1株当たり当期純損失(△) |
(円) |
△ |
△ |
△ |
△ |
|
|
潜在株式調整後 1株当たり当期純利益 |
(円) |
|
|
|
|
|
|
自己資本比率 |
(%) |
|
|
|
|
|
|
自己資本利益率 |
(%) |
|
|
|
|
|
|
株価収益率 |
(倍) |
|
|
|
|
|
|
配当性向 |
(%) |
|
|
|
|
|
|
営業活動による キャッシュ・フロー |
(千円) |
|
|
|
△ |
|
|
投資活動による キャッシュ・フロー |
(千円) |
|
|
|
△ |
|
|
財務活動による キャッシュ・フロー |
(千円) |
|
|
|
|
|
|
現金及び現金同等物の 期末残高 |
(千円) |
|
|
|
|
|
|
従業員数 |
(人) |
|
|
|
|
|
|
(外、平均臨時雇用者数) |
( |
( |
( |
( |
( |
|
(注)1.当社は連結財務諸表を作成しておりませんので、連結会計年度に係る主要な経営指標等の推移については記載しておりません。
2. 持分法を適用した場合の投資利益については、当社は関連会社を有していないため記載しておりません。
3. 1株当たり配当額及び配当性向については、配当を実施していないため記載しておりません。
4. 潜在株式調整後1株当たり当期純利益については、第2期、第3期、第4期及び第5期は潜在株式は存在するものの、当社株式は非上場であり期中平均株価が把握できず、また1株当たり当期純損失であるため記載しておりません。第6期は潜在株式は存在するものの、当社株式は非上場であり期中平均株価が把握できないため記載しておりません。
5.自己資本利益率については、第2期から第5期までは当期純損失であるため記載しておりません。
6.株価収益率については、当社株式は非上場であるため、記載しておりません。
7.第2期、第3期及び第4期については、キャッシュ・フロー計算書を作成していないため、キャッシュ・フローに係る各項目については記載しておりません。
8.従業員数は就業人員(当社から社外への出向者を除き、社外から当社への出向者を含む。)であり、臨時雇 用者数(パートタイマー、人材会社からの派遣社員、季節工を含む。)は、年間の平均人員を( )外数で記載しております。
9.主要な経営指標等の推移のうち、第2期、第3期及び第4期については、会社計算規則(平成18年法令省令第13号)の規定に基づき算出した各数値を記載しており、金融商品取引法第193条の2第1項の規定に基づく監査証明を受けておりません。
10.第5期及び第6期の財務諸表については、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、有限責任 あずさ監査法人の監査を受けております。
11.「収益認識に関する会計基準」(企業会計基準第29号 2020年3月31日)等を第5期の期首から適用しており、第5期及び第6期に係る主要な経営指標等については、当該基準等を適用した後の指標等となっております。
12.当社は2023年5月17日付で、第1回A種種類株式、第2回A種種類株式、B種種類株式、第1回C種種類株式、第2回C種種類株式及びD種種類株式の全てを自己株式として取得し、対価として普通株式を交付しております。また、当社が取得した第1回A種種類株式、第2回A種種類株式、B種種類株式、第1回C種種類株式、第2回C種種類株式及びD種種類株式の全てについて、2023年5月17日開催の取締役会決議により消却しております。なお、当社は、2023年6月2日開催の臨時株主総会により、種類株式を発行する旨の定款の定めを廃止しております。
13.当社は、2023年6月2日付で普通株式1株につき200株の割合で株式分割を行っております。第5期の期首に当該株式分割が行われたと仮定して1株当たり純資産額及び1株当たり当期純利益又は1株当たり当期純損失を算定しております。
14.当社は、2023年5月17日開催の取締役会決議により、2023年6月2日付で普通株式1株につき200株とする株式分割を行っており、発行済株式総数は56,443,800株となっております。
そこで、東京証券取引所自主規制法人(現 日本取引所自主規制法人)の引受担当者宛通知「『新規上場申請のための有価証券報告書(Ⅰの部)』の作成上の留意点について」(2012年8月21日付東証上審第133号)に基づき、第2期の期首に当該株式分割が行われたと仮定して算定した場合の1株当たり指標の推移を参考までに掲げると、以下のとおりとなります。
なお、第2期、第3期及び第4期の数値(1株当たり配当額についてはすべての数値)については、有限責任 あずさ監査法人の監査を受けておりません。
|
回次 |
第2期 |
第3期 |
第4期 |
第5期 |
第6期 |
|
|
決算年月 |
2019年8月 |
2020年8月 |
2021年8月 |
2022年8月 |
2023年8月 |
|
|
1株当たり純資産額 |
(円) |
△28.39 |
△62.81 |
△58.19 |
△72.35 |
79.28 |
|
1株当たり当期純利益又は1株当たり当期純損失(△) |
(円) |
△24.64 |
△34.42 |
△15.08 |
△39.78 |
3.96 |
|
潜在株式調整後1株当たり当期純利益 |
(円) |
- |
- |
- |
- |
- |
|
1株当たり配当額 |
(円) |
- |
- |
- |
- |
- |
|
(うち1株当たり中間配当額) |
(-) |
(-) |
(-) |
(-) |
(-) |
|
2【沿革】
|
2017年10月 |
創薬研究を目的として、神奈川県藤沢市の湘南ヘルスイノベーションパーク内にてChordia Therapeutics株式会社を設立 |
|
2017年11月 |
武田薬品工業株式会社とライセンス契約を締結し、4つのパイプラインの全世界での独占的に研究、開発、製造及び商業化する権利を獲得 |
|
2017年11月 |
武田薬品工業株式会社、京都大学イノベーションキャピタル株式会社、他数社を引受先とする出資契約を締結 |
|
2018年8月 |
抗がん薬化合物CTX-712の日本での第1相臨床試験を開始 |
|
2019年3月 |
ジャフコ グループ株式会社、京都大学イノベーションキャピタル株式会社、他数社を引受先とする出資契約を締結 |
|
2019年4月 |
東京都中央区に東京事務所を開設 |
|
2020年12月 |
小野薬品工業株式会社に対し、当社が保有する抗がん薬化合物CTX-177及びその関連化合物を全世界で独占的に研究、開発、製造及び商業化する権利について、ライセンス契約を締結 |
|
2022年5月 |
日本グロースキャピタル投資法人、東京大学協創プラットフォーム開発株式会社、MEDIPAL Innovation 投資事業有限責任組合、新生キャピタルパートナーズ株式会社、及び日本ベンチャーキャピタル株式会社、シオノギファーマ株式会社を引受先とする出資契約を締結 |
|
2022年5月 |
株式会社メディパルホールディングスとの将来的な流通及び販売促進等における業務提携に関する基本合意書を締結 |
|
2022年5月 |
シオノギファーマ株式会社と低分子化合物の製造における協業に関する基本契約書を締結 |
|
2022年8月 |
導出先である小野薬品工業株式会社が抗がん薬化合物CTX-177(ONO-7018)の米国での第1相臨床試験を開始 |
|
2023年2月 |
抗がん薬化合物CTX-712の米国での第1/2相臨床試験を開始 |
|
2023年8月 |
抗がん薬化合物CTX-712の日本での第1相臨床試験の症例登録完了 |
|
|
|
3【事業の内容】
(1)事業の概要
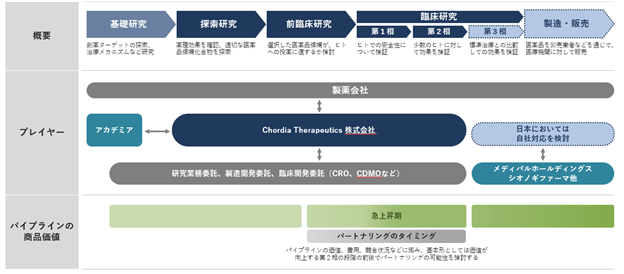
① ビジネスモデル
当社は、新規抗がん薬の市販を目指して研究開発を行う創薬ベンチャー企業です。医療ニーズ(アンメットメディカルニーズ)の高いがん領域で、新しい作用を有する低分子の画期的医薬品(ファーストインクラス)の研究開発が主要な事業の内容です。当社がマネジメントと研究業務(探索研究、前臨床研究、臨床研究)、特に候補化合物の探索、評価、最適化、臨床試験に集中し、外部協力先が得意な業務、中でも基礎研究、原薬及び製剤の製造、流通・販売などは各外部協力先に委託するという形を取ってビジネスを進めております。
創薬事業においては様々な専門性の高い作業や過程があり、また長い開発期間と多額の研究開発費用が必要です。当社は、効率的な創薬事業を実現するために、大学や公的機関、事業補完性のある企業、製薬会社などと積極的に共同研究やライセンス提携などの協業を行い、より短い期間で効率的に新しい抗がん薬の創出に取り組んでいます。
・パートナリングに関する方針、考え方
当社における事業提携の基本戦略は、パイプライン(開発プログラム)の医薬品として市販される蓋然性が高まったタイミングで日本国外の販売権についてライセンス交渉を行う事です。2021年のBiotechnology Innovation Organizationの報告では、第2相臨床試験の成功確率が最も低いとされており、第2相臨床試験が成功してパイプラインが医薬品として市販される蓋然性が高まったタイミングは、パイプラインの価値が高くなるタイミングと当社は考えております。そのため事業提携の基本戦略としては第2相臨床試験の結果を確認できるタイミングで行うことが最適であると当社では考えています。
パートナー企業の選定基準としては、①パートナー企業の臨床開発戦略立案力、②パートナー企業の臨床開発に関する資金力、③当社のパイプラインの理解力、④パートナー企業内での当社のパイプラインの優先順位などを基準に選定を行います。
<事業系統図>
② ファーストインクラスの抗がん薬を生み出すための研究開発
がんは世界において主要な死因の一つであり、国立がん研究センターの統計によると日本人が一生のうちにがんと診断される確率(国立がん研究センター がん情報サービス、がん統計まとめHPで2019年のデータに基づく)は、2人に1人ががんと診断され、また、がんで死亡する確率(国立がん研究センター がん情報サービス、がん統計まとめHPで2021年のデータに基づく)は5人に1人が死亡しています。そのため、患者や家族、社会にとって、がんは大きな問題になっています。また、近年、新しい治療法や新規抗がん薬が開発され、生存予後が改善する傾向がみられていますが、がんと診断された人の5年相対生存率(2009年-2011年にがんと診断された人のデータに基づいて当社で算定)は男女計で64.1%にとどまり、依然として新しい抗がん薬や治療法の開発が望まれています(国立がん研究センター がん情報サービス、がん統計まとめHP)。このことから、がん領域は依然としてアンメットメディカルニーズが高い領域と考えています。
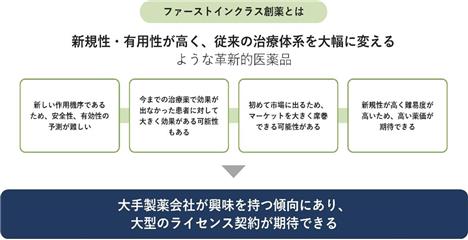
当社は、がん領域において、ファーストインクラスの研究開発を行っています。ファーストインクラスの医薬品は、既存治療薬と異なる有用性を示すことが期待され、これまでの治療法を大きく変えることができる医薬品に成長する可能性があると考えています(図1)。特に既存治療薬では十分な効果が認められず、現在のがんの進行に不安を感じている多くの患者に対して、がんの進行をコントロールできるという希望を届けられる可能性を秘めております。医薬品市場の観点からは、初めて市場に出るため大きな市場を取れる可能性が高く、薬価算定の際にその有効性や新規性に応じた高い価格が設定されることが多いことから、数多くのグローバル製薬企業が非常に高い関心を持っていると考えています。そのため、ファーストインクラスの医薬品にフォーカスしたパイプラインを有する当社は、グローバル製薬企業との共同開発やライセンス契約等の機会を積極的に検討しながら事業の価値最大化をめざすことが可能になります。
図1.ファーストインクラス創薬とは
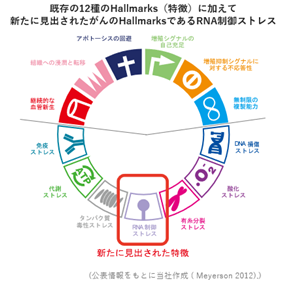
③ 当社の研究領域
|
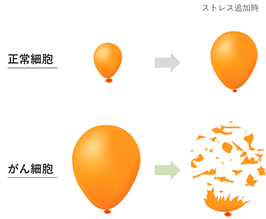
抗がん薬の標的となる分子を見つけ出すには、がんのホールマーク(特徴)、つまり、がん細胞が正常細胞と比べてどのように異なるのかを明らかにすることが重要です。これまでに、12種の多様なホールマーク(継続的な血管新生、組織への浸潤と転移、アポトーシスの回避、増殖シグナルの自己充足、増殖抑制シグナルに対する不応答性、無制限の複製能力、DNA損傷ストレス、酸化ストレス、有糸分裂ストレス、タンパク質毒性ストレス、代謝ストレス、及び免疫ストレス)が見出されていましたが、近年、最新の研究によって、RNA制御ストレスが新たなホールマークとして認識されるようになりました(右図、枠内がRNA制御ストレス)。がんのホールマーク(特徴)に着目した医薬品開発はこれまでにも盛んに行われてきており、優れた抗がん薬が多数生み出されてきたことから、高い効能を有する抗がん薬の開発において有効な研究戦略であると考えています。
|
|
・がんの新しいホールマークである“RNA制御ストレス”
RNA制御ストレスとは、細胞内でRNAを生成する過程に乱れが生じ、異常なRNAが蓄積し、それが細胞へ負荷をかけている状態のことです。特にがん細胞ではRNAを生成する複数の過程が乱れ、正常細胞に比べてがん細胞では過剰に負荷がかかっている状態です。当社の研究開発は、この新たに同定されたがんのストレス表現型である、RNA制御ストレスに焦点を当てています。当社のパイプラインは、RNA制御ストレスを標的とするコンセプト、すなわち異常RNAをさらに生成、蓄積させることでがん細胞に追加の負荷をかけて死に至らしめるという科学的なコンセプトに基づいています(図2)。RNA制御ストレスを標的としたがん治療薬は未だ医薬品として市販されていません。当社は、このRNA制御ストレスにいち早く注目して研究開発を行っており、当領域におけるリーディングカンパニーとして、新しい抗がん薬の研究開発を世界に先駆けて行っています。
図2.RNA制御ストレスとは
④ パイプラインの概要
当社は現在、2つの臨床パイプライン(CLK阻害薬、MALT1阻害薬)に加えて、1つの前臨床研究段階のパイプライン(CDK12阻害薬)、探索研究段階のパイプライン2つ(GCN2阻害薬、新規パイプライン)、合計5つのパイプラインを保有しています(図3)。そのうちMALT1阻害薬は全世界での開発及び商用化の権利を小野薬品工業株式会社に導出しておりますが、その他のパイプラインは全世界での権利を当社が有しています。
図3.パイプラインの概要と開発状況と開発タイムライン

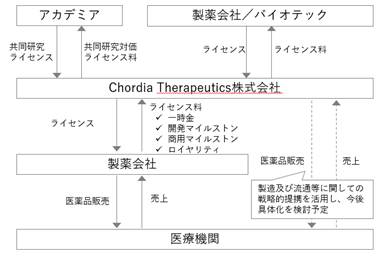
⑤ 収入形態
当社が得る収入は、当面の間は、ライセンス契約に基づく提携企業からの収入を想定しています。ライセンス契約の収入には、「契約一時金」「開発マイルストン収入」「販売マイルストン収入」「ロイヤリティ収入」があります。また、当社は自社でも製造や販売する体制を構築することを視野にいれてパートナー企業との戦略的提携を進めていますので、今後のビジネスの進展により自社で製品を販売して得る収入も想定しています。
当社は、2020年12月に小野薬品工業株式会社との間で全世界におけるCTX-177の独占的ライセンス契約を締結いたしました。この契約に基づき、2020年12月に8億円の契約一時金を受け取っております。また、2023年2月には初回開発マイルストンとして25億円を受け取っております。今後、開発が順調に進んだ場合には、さらなる開発マイルストン収入を受け取るだけでなく、申請・承認された後で販売マイルストン収入やロイヤリティ収入を受け取る事ができます。
<事業収益の類型>
|
収入形態 |
内容 |
|
ライセンスの契約一時金 |
ライセンス契約を行った際に独占的な権利をパートナーに付与する対価として得られる一時金収入。 |
|
ライセンスの開発マイルストン |
ライセンス契約を行ったパイプラインの開発進捗に応じて設定したいくつかの目標を達成する毎に一時金として得られる収入。臨床試験段階での開発マイルストンについては、目標間の期間は数年程度と想定する。 |
|
ライセンスの販売マイルストン* |
ライセンス契約を行った際に設定した売上目標達成に応じて受領する収入。 |
|
ライセンスのロイヤリティ* |
製品が市販後に、その売上からあらかじめ定められた一定割合を受領する収入。 |
*:現時点での受領実績はないが、受領するために必要なライセンス契約は既に締結されている。
**:現時点では自社で製品を販売する意思決定は行われていないため、計画上で想定される「製品の販売収入」につ
いては表中に記載されていない。
(2)個別パイプラインの状況
① RNA制御ストレスに焦点を当てたパイプライン
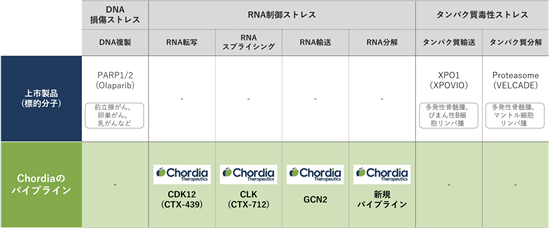
RNAを生成する過程には、転写、スプライシング、分解、輸送などが挙げられます。これら各過程を標的とした抗がん薬は未だに市販されていません。当社はこれらに対するパイプラインを有しており、いずれのパイプラインも医薬品として市販されておらず、ファーストインクラスの医薬品になる可能性を有しています(図4)。特に当社のメインパイプラインであるCTX-712により、RNA制御ストレスを標的とした抗がん薬の有用性が立証されれば、RNA制御ストレスを対象とした抗がん薬の開発において新たな一歩が示せると考えています。
また、がん特有のホールマークは複数のがん種において共通して認められることから、このホールマークに焦点を当てた創薬研究は一つのがん種に限定されず、多くのがん種に対して適応できることが期待されます。実際に、既知のホールマークを標的とした医薬品は、市販後に適応とされるがん種が拡大され、ブロックバスターとして成長したケースがあり、当社が焦点を当てるホールマークであるRNA制御ストレスにおいても同様、幅広いがん種に適応する可能性があると考えています。すなわち、当社の研究アプローチは、既に市販されている医薬品にて実績のあるアプローチです。
図4.DNA、RNA及びタンパク質に係るストレスを標的とした市販済みのがん治療薬の現状と当社パイプライン
② 当社のパイプラインの標的となるRNAを生成する過程
DNAは生命活動の維持に不可欠な、タンパク質を合成するための設計図として機能しています。DNA上の遺伝情報は、メッセンジャーRNA(mRNA)へ写しとられ、このmRNAの情報をもとにタンパク質が作られます。当社のパイプラインは、mRNAを生成する過程に対してかかる制御ストレスを標的としており、イメージ図(図5)においては、A:転写を調節するCDK12、B:スプライシングを調節するCLK、C:RNA輸送を調節するGCN2、D:RNA分解を調節する新規パイプラインとして記載しています。
図5.RNAを生成する過程のイメージ図
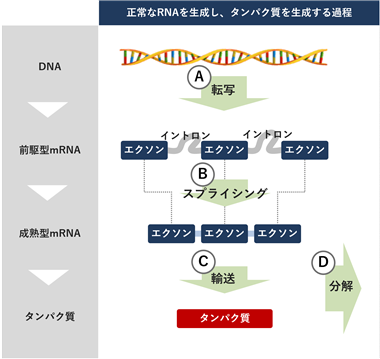
ウイルスからヒトに至る多くの生物は遺伝子DNAを有しています。DNAは生命活動の維持に不可欠な、タンパク質を合成するための設計図として機能しています。DNA上の遺伝情報は、メッセンジャーRNA(mRNA)へ写しとられ、このmRNAの情報をもとにタンパク質が作られます。「DNA→mRNA→タンパク質」という細胞内における遺伝情報の流れは、生命の営みの基本的かつ普遍的な反応であることからセントラルドグマと呼ばれています。
RNAの転写とは、上記のセントラルドグマの中で、DNA情報をmRNAに写しとる過程です。この転写過程を直接つかさどっている重要なタンパク質としてRNAポリメラーゼⅡが知られています。RNAポリメラーゼⅡはDNAを鋳型として前駆型mRNAを作ります。
RNAのスプライシングとは、転写後の前駆型mRNAはタンパク質を作るために必要なエクソン配列に加えてタンパク質合成に不要なイントロン配列の両方を含んでいるため、エクソン配列を繋げ、イントロン配列を取り除き、成熟型mRNAを作る過程です。
RNAの輸送とは、スプライシングを受けた成熟型mRNAやタンパク質を作るために必要なトランスファーRNA(tRNA)をタンパク質合成の場に輸送する過程です。
RNAの分解とは、タンパク質合成の鋳型として役割を果たしたmRNAやtRNAが分解される過程です。
Ⅰ.CTX-712(CLK阻害薬)
① 作用
CLKはスプライシングを調節しています。CTX-712がCLKを阻害することによって正常のスプライシングが行われなくなるため、異常なmRNAが蓄積し、細胞に負荷がかかります。そもそも、がん細胞には過剰に負荷がかかっているためCLK阻害による追加の負荷に耐えられず、正常細胞に比べてがん細胞が選択的に死滅すると考えています。
② 特徴及び対象疾患
正常なスプライシングを阻害する作用の抗がん薬はこれまで市販されていないため、これまでの治療法で効果が無かった患者に対して新たな治療法となる可能性があると考えております。非臨床試験の結果からは、急性骨髄性白血病(AML)や骨髄異形成症候群(MDS)などの血液がんのみならず、卵巣がんなど複数の固形がんに対しても有効性が期待されていると考えております。
また患者を対象にした国内第1相臨床試験の結果からも、再発・難治性の急性骨髄性白血病(AML)、骨髄異形成症候群(MDS)、卵巣がんがCTX-712に対する感受性が高いことが示唆されました。非臨床試験である動物モデルと実際の臨床試験が大きく相違ない結果であり、CTX-712は特定の特徴を有する複数種類のがんにおいて効果が期待されると考えております。
③開発状況
2018年から実施中のCTX-712の日本国内第1相臨床試験では、2023年8月に全ての患者登録が完了し、固形がん46名、血液がん14名合わせて60名の患者への投薬が行われました。当社は第1相臨床試験の結果報告を2022年6月の米国臨床腫瘍学会及び12月の米国血液学会及び2024年4月の米国癌学会の年次総会で報告しました。
米国臨床腫瘍学会では、2021年12月時点までの固形がん(用量漸増コホート16名、拡大コホート10名)と血液がん(用量漸増コホート4名)を対象とした第1相臨床試験の薬物動態と安全性プロファイルを報告しました。観察されたDLT(Dose-Limiting Toxicity:用量制限毒性)は、脱水、血小板数減少、低カリウム血症であり、週2回の投与におけるMTD(Maximum Tolerated Dose:最大耐用量)は140 mgと決定されました。有効性に関しては、卵巣がんと急性骨髄性白血病患者において、それぞれ2例のPR (partial response:部分奏効)と2例のCR(complete remission:完全寛解)が認められました。さらにPK(pharmacokinetics:薬物動態)解析では、用量依存的な全身曝露量の増加が観察され、PD(pharmacodynamics:薬力学的)マーカーとして設定したRNAのスプライシング変化が用量依存的に増加したことから、CTX-712による薬力学的反応が確認されました。
米国血液学会では、2022年10月時点までの第1相臨床試験の血液がんに関する追加の報告を行いました。急性骨髄性白血病及び骨髄異形成症候群患者8例にて4例のCR(complete remission:完全寛解)と1例のCRi(好中球未回復の完全寛解)が認められ、米国臨床腫瘍学会で発表済みの成績を合わせて、臨床試験におけるPOC(Proof of Concept(概念実証))が確認できました。(図6)
米国がん学会では、2023年11月時点までの第1相臨床試験の安全性、有効性、ゲノム情報、薬物動態に関して、46名の固形がん、及び14名の血液がんの結果を報告しました。観察されたDLT(Dose-Limiting Toxicity:用量制限毒性)は、脱水、血小板数減少、低カリウム血症,及び肺炎であり、週2回の投与におけるMTD(Maximum Tolerated Dose:最大耐用量)は140 mgと決定されました。CTX-712に関連する有害事象として吐き気、嘔吐、下痢等が挙げられましたが、許容される安全性プロファイルと考えられました。有効性に関しては、固形がんにおいて4例のPR(partial response:部分奏効)を認め、それらはすべて卵巣がん(4/14例、28.6%)でした。Myc amplificationを有する卵巣がんに着目すると、3例中2例(66.7%)でPRが得られました。AML、MDS計14例において、4例のCR(complete remission:完全寛解)、1例のCRi(complete remission with incomplete hematologic recovery:好中球未回復の完全寛解)、1例のMLFS(morphologic leukemia-free state:形態学的無白血病状態)を認め、Overall Response Rateは42.9%でした。また、そのうちSplicing Factor mutationのある4例に着目すると3例(75%)の奏効が認められました。奏効を得た症例のうち3例は投与期間が300日以上と長期間の奏効を認め、そのうち1例は974日であった。さらにPK(pharmacokinetics:薬物動態)解析では、用量依存的な全身曝露量の増加が観察され、PD(pharmacodynamics:薬力学的)マーカーとして設定したRNAのスプライシング変化が用量依存的に増加したことから、CTX-712による薬力学的反応が確認されました。以上より、卵巣がん、血液がんにおいてCTX-712が有効であることを示しました。
本書提出日現在では、再発難治性の血液がんの米国第1/2相臨床試験を進めており、2024年2月時点では12人の患者への投与を完了し、更なる症例登録を進めている状況でございます。
図6.固形がんの40症例における腫瘍サイズの変化率(卵巣がん10症例が緑色、その他固形がんはグレーで示す)
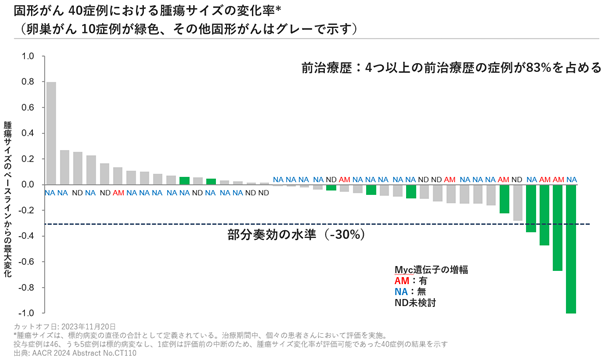
図7.AML&MDS 14症例における奏功と治療期間
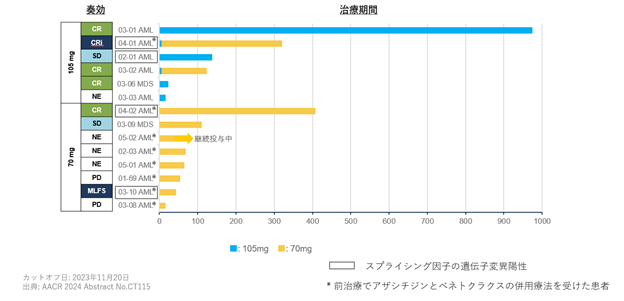
④今後の開発計画
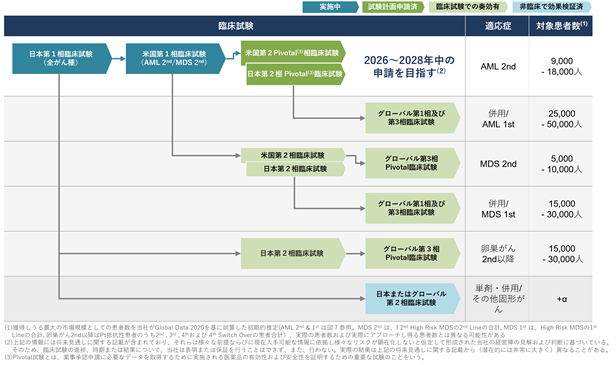
日本国内第1相臨床試験において複数の急性骨髄性白血病患者で奏効が確認できたことを受けて、当社はアンメットメディカルニーズの高い再発難治性の急性骨髄性白血病での開発を優先して進めていく計画を有しています。急性骨髄性白血病は、がんの中でもすい臓、胆のう・胆管のがんに続いて3番目に低い5年相対生存率となっており、新しい治療法の開発が待ち望まれていると考えております(図8)。急性骨髄性白血病における世界の年間罹患数は日本、米国、欧州主要国においてそれぞれ約9千人、2万2千人、1万3千5百人と報告されています(図9)。新たに急性骨髄性白血病を発症された患者のおよそ半分の方は強力な化学療法を受け、およそ25%程度の患者は強力な化学療法ではない薬物治療を受けるとされています。1次治療を受けたおよそ半分の患者は、治療効果が不十分もしくは再発して2次治療が必要になりますが、そのおよそ半分の患者は特定の遺伝子変異を有しており、対応する分子標的薬による治療を受けることが多いと、当社では分析しています。残りの50%程度の患者に加えて、分子標的薬による治療が失敗してさらなる治療が必要になる患者が、CTX-712による治療の対象になると当社では考えています(図10)。当面は、再発難治性の急性骨髄性白血病での開発を優先させて、迅速承認制度の活用も視野に入れながら、1日でも早い承認を目指していきます。さらに、日本国内第1相臨床試験においてCTX-712は卵巣がんや骨髄異形成症候群でも奏効が確認できており、それらがん種でも順次開発を進めて適応を拡大し、CTX-712の製品価値の最大化に努めていきます(図11)。とくに卵巣がんではプラチナ製剤による治療に抵抗性を獲得してしまい治療選択肢が少ない患者に対して有効である可能性が示されており、今後、自社開発もしくは大手製薬会社との共同開発の可能性を積極的に探っていく計画です。
図8.がんにおける5年相対生存率とCTX-712が最初に狙う適応症
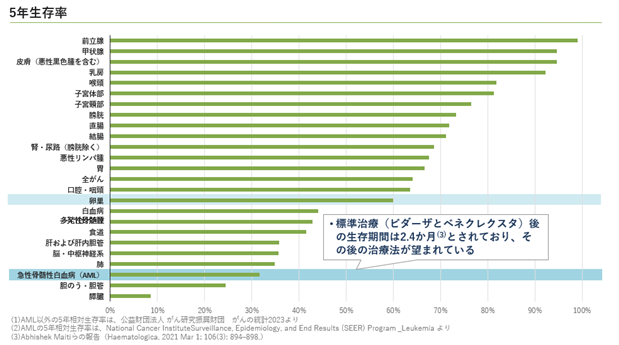
図9.世界の急性骨髄性白血病の罹患者数
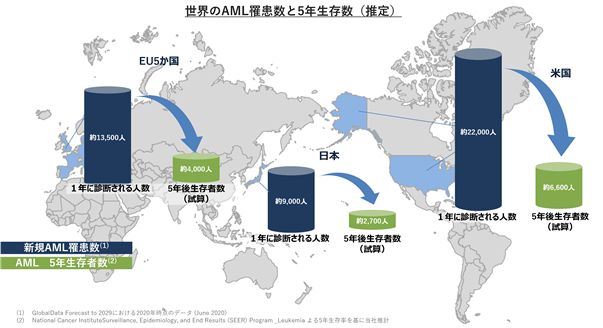
図10.急性骨髄性白血病における治療体系とCTX-712の最初の対象患者
図11.CTX-712の臨床試験戦略
⑤ライセンス状況
本書提出日現在、武田薬品工業株式会社とのライセンス契約に基づき全世界での独占的な研究、開発、製造及び商業化する権利は、当社が保有しています。今後の研究開発状況にあわせてライセンス活動を積極的に行って参ります。
⑥共同研究状況
国内第1相臨床試験を国立研究開発法人 国立がん研究センター中央病院、他複数施設と協力して実施中です。また京都大学と造血器腫瘍の患者のなかで奏効が期待される患者を層別するためのバイオマーカーに関する共同研究を実施中です。また、国立がん研究センターの研究所と固形腫瘍の患者のなかで奏効が期待される患者を層別するためのバイオマーカー研究も実施中です。この共同研究において、富士通株式会社を組み入れた研究にも2023年より取り組んで参りました。加えて、非臨床研究としては、2022年に国立研究開発法人日本医療研究開発機構(AMED)からの支援を受けて革新がん医療実用化事業に採択され、京都大学(代表機関)と共同研究を行っており、この研究の派生として2023年から同革新がん医療実用化事業において大分大学(代表機関)との共同研究を実施しました。
Ⅱ.CTX-177(MALT1阻害薬)
①作用
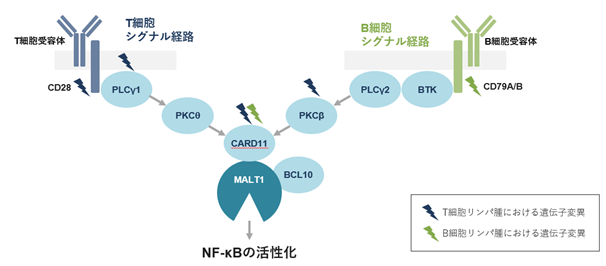
MALT1は転写因子NF-κBを活性化します。難治性リンパ腫においては、T細胞シグナルあるいはB細胞シグナル伝達経路の因子(T細胞受容体CD28、B細胞受容体CD79A/B、PLCγ1,PKCβ、CARD11)にシグナルを活性化する遺伝子変異が起こり、そのシグナルがBTKやMALT1を経由してNF-κBの活性化が引き起こされ、リンパ腫が異常に増殖しています(図12)。
CTX-177は、MALT1を阻害してNF-κBの活性化を抑制する事で抗がん作用を生み出すと考えています。本パイプラインはRNA制御ストレスを標的としてはいません。
②特徴及び対象疾患
MALT1阻害薬は難治性リンパ腫での有効性が期待されています。いくつかの難治性リンパ腫ではBTK阻害薬による治療が行われています。しかしながら、MALT1がNF-κBを活性化することによりBTK阻害薬に耐性を獲得したリンパ腫が出現しており、治療上の問題となっています。MALT1阻害薬はNF-κBの活性化を抑制することが可能であるため、BTK阻害薬に耐性のリンパ腫においても効果を示すことが期待されています。
図12.CTX-177の作用のイメージ
③開発状況
小野薬品工業株式会社に対して独占的な開発販売権を許諾しており、現在、導出先である小野薬品工業株式会社にて米国で再発又は難治性の非ホジキンリンパ腫もしくは慢性リンパ性白血病の患者を対象に第1相臨床試験が実施中です。
④ライセンス状況
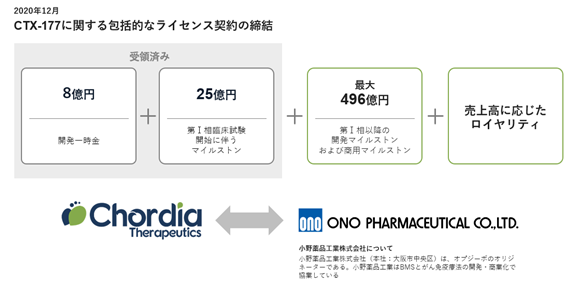
2020年12月にMALT1阻害薬CTX-177及びその関連化合物に関するライセンス契約を小野薬品工業株式会社と締結しました。本契約の締結に伴い、全世界においてCTX-177及びその関連化合物を独占的に研究、開発、製造及び商業化する権利を小野薬品工業株式会社に許諾し、当社は、契約一時金及び第1相試験開始時の開発マイルストンの合計として33億円(うち契約一時金は8億円)、その後の開発の進捗及び売上高に応じたマイルストンとして最大496億円を小野薬品工業株式会社から受領します。また、CTX-177の全世界での売上高に応じたロイヤリティを小野薬品工業株式会社より受領します(図13)。
なお、小野薬品工業株式会社が独占的に研究、開発、製造及び商業化する権利を取得しているため、臨床開発費用やその後の費用は当社が負担する予定はありません。
図13.小野薬品工業株式会社とのライセンス契約内容
Ⅲ.CTX-439(CDK12阻害薬)
①作用
CDK12はRNAポリメラーゼⅡによるmRNAの転写を調節しています。CTX-439は、CDK12を阻害することによってRNAポリメラーゼⅡによるmRNAの転写を抑制します。このmRNAの転写の抑制により異常なmRNAが蓄積し、細胞に負荷がかかります。そもそも、がん細胞には過剰に負荷がかかっているためCDK12阻害による追加の負荷に耐えられず、正常細胞に比べてがん細胞が選択的に死滅すると考えています。
②特徴及び対象疾患
CTX-439は、単剤で乳がん及び卵巣がんを含むその他複数の固形がん及び血液がんのマウスモデルで抗がん作用を示しております。加えて、化学療法薬あるいは分子標的薬の魅力的な併用薬となる可能性を有しています。
③開発状況
本書提出日現在、GMP基準に準拠した治験薬の製造等の第1相臨床試験開始に向けた準備を進めております。
④ライセンス状況
本書提出日現在、武田薬品工業株式会社とのライセンス契約に基づき全世界での独占的な研究、開発、製造及び商業化する権利は、当社が保有しています。今後の研究開発状況にあわせてライセンス活動を積極的に行って参ります。
⑤共同研究状況
2021年から2023年の3年間、国立研究開発法人日本医療研究開発機構(AMED)からの支援を受けて、革新がん医療実用化事業において採択され、京都大学(代表機関)、東京大学等との共同研究により、今後の臨床試験において奏効が期待される患者を層別するためのバイオマーカー探索研究および作用解明に基づいた併用戦略の構築を実施中です。この共同研究はさらに継続して、2025年まで実施を予定しております。
Ⅳ.GCN2阻害薬
①作用
GCN2は、タンパク質を作るために必要なtRNAの輸送を調節しています。GCN2阻害薬は、tRNAの輸送に異常を生じさせ、輸送が正常に行われなかった異常なtRNAが蓄積し、細胞に負荷がかかります。そもそも、がん細胞には過剰に負荷がかかっているためGCN2阻害による追加の負荷に耐えられず、正常細胞に比べてがん細胞が選択的に死滅すると考えています。
②特徴及び対象疾患
GCN2阻害薬は、単剤で異常なtRNAを誘導することによる抗腫瘍効果を示すことが期待されます。加えて、化学療法薬あるいは分子標的薬の魅力的な併用薬となる可能性を有しています。
③開発状況
本書提出日現在、第1相臨床試験の開始に向けて探索研究を実施中です。
④ライセンス状況
本書提出日現在、武田薬品工業株式会社とのライセンス契約に基づき全世界での独占的な研究、開発、製造及び商業化する権利は、当社が保有しています。今後の研究開発状況にあわせてライセンス活動を積極的に行って参ります。
⑤共同研究状況
名古屋市立大学等との共同研究により、今後の臨床試験対象となるがん種の選定を実施中です。
(4)用語説明(五十音順)
|
用語 |
解説 |
|
RNA |
Ribonucleic acidリボ核酸の略で、遺伝子であるDNAからタンパク質を生成するために必要な物質。ゲノムDNAから転写されたメッセンジャーRNA(mRNA)、タンパク質合成時に利用されるトランスファーRNA(tRNA)などがある |
|
RNAポリメラーゼⅡ |
DNAからmRNAへの転写を触媒するタンパク質複合体 |
|
アンメットメディカルニーズ |
未だ有効な治療法がない疾患に対する医療ニーズ |
|
イントロン |
タンパク質合成に不必要なRNA部分 |
|
AML |
Acute Myeloid Leukemia急性骨髄性白血病の略で、骨髄中で白血球の元になる血液細胞ががん化した疾患で、血液がんのひとつ |
|
エクソン |
タンパク質合成に必要なRNA部分 |
|
エクソンスキッピング |
一部のエクソンが抜け落ちるスプライシングの変化 |
|
FDA |
Food and Drug Administration米国食品医薬品局の略で、医薬品などを審査、取り締まるアメリカ合衆国の政府機関 |
|
NF-κB |
Nuclear Factor-kappa Bの略で、転写を担うタンパク質複合体のひとつ |
|
MFLS |
CRには至らないものの、形態学的には骨髄中に白血病細胞が見られない状態 |
|
MDS |
Myelodysplastic syndromes骨髄異形成症候群の略で、骨髄中で血液細胞のもとになる造血幹細胞に異常がおき、正常な血液細胞がつくなれなくなる疾患で、血液がんのひとつ |
|
MTD |
Maximum Tolerated Dose最大耐量の略で、毒性が認容できる範囲内で最大の投与量 |
|
CARD11 |
Caspase Recruitment Domain Family Member 11の略で、MALT1の活性調節に働くタンパク質 |
|
拡大コホート |
第1相臨床試験のなかで、次相の推奨使用用量の設定後、安全性と一部有効性を確認するために症例を集めた患者集団のこと |
|
血管新生 |
新しい血管が作られる現象のことで、創傷部位やがんが進行する際にも認められる現象 |
|
血液がん |
血液細胞が分化の過程でがん化して増殖する疾患の総称 |
|
好中球 |
細菌などの感染から体を守る働きを有した白血球の一種。白血球全体の約45~75%を占めている。 |
|
固形がん |
血液がん以外の、臓器や組織などで塊をつくるがんの総称 |
|
最大耐量 |
毒性が認容できる範囲内で最大の投与量、MTDのこと |
|
CR |
Complete Remission完全寛解の略で、血液がんの評価において使用され、患者の骨髄に存在するがん細胞の割合が5%未満であり、末梢血中の好中球と血小板などの数値が完全に回復している状態 固形がんの評価におけるCRは、Complete Response完全奏効の略で用いられ、腫瘍が完全に消失した状態 |
|
CRi |
Complete Remission with incomplete hematologic recoveryの略で、血液がん(AML)の評価において使用され、患者の骨髄に存在するがん細胞の割合が5%未満であるが、末梢血中の好中球と血小板の回復が不完全な状態 |
|
CLK |
CDC2-Like Kinaseの略で、対象となるタンパク質にリン酸基を転移させる反応を触媒する酵素でスプライシングにおいて重要な役割を果たしている |
|
CDK12 |
Cyclin Dependent Kinase 12の略で、対象となるタンパク質にリン酸基を転移させる反応を触媒する酵素で転写の伸長反応において重要な役割を果たしている |
|
GCN2 |
General Control Nonderepressible 2の略で、対象となるタンパク質にリン酸基を転移させる反応を触媒する酵素で細胞内のアミノ酸の量において重要な役割を果たしている |
|
浸潤 |
がん細胞や免疫細胞などが周辺組織に染み広がる特徴のことで、転移するがんが有している特徴の一つである |
|
スプライシング |
RNAを成熟させる過程 |
|
成熟型mRNA |
スプライシングを受けて成熟したRNA |
|
前駆型mRNA |
スプライシングを受けて成熟する前のRNA |
|
前臨床研究 |
臨床試験を実施する前に検討する研究。ヒトにおける医薬品候補化合物の安全性、薬物濃度、有効濃度などを推定する研究の総称 |
|
探索研究 |
医薬品の研究開発の初期段階であり、病態の進展に寄与している生体分子(薬物標的)を探索する研究 |
|
用語 |
解説 |
|
治療モダリティ |
治療薬の種類のことで、低分子医薬品、抗体医薬品、核酸医薬品、細胞医薬品などがある |
|
DNA |
Deoxyribonucleic acidデオキシリボ核酸の略で、DNAには全ての遺伝情報が蓄えられている |
|
DLT |
Dose-Limiting Toxicity用量制限毒性の略で、臨床試験において増量できない理由となる毒性のこと |
|
転写 |
遺伝情報をDNAからメッセンジャーRNAにコピーする過程 |
|
バイオマーカー |
ある疾患の有無、病状の変化や治療の効果の指標となる生体内の物質。特に抗がん薬領域では患者の層別化に用いることが多い |
|
パイプライン |
研究開発プログラムもしくは医薬品候補化合物 |
|
曝露 |
生体に化学物質がさらされていること |
|
PR |
Partial Remission部分寛解の略で、血液がんの評価において使用され、骨髄に存在するがん細胞の割合が5-25%(AMLの場合)あるいは5%以上(MDSの場合)であるが、治療前に比べ50%減少した状態 固形がんの評価におけるPRは、Partial Response部分奏効の略で用いられ、標的病変の径の和が30%以上減少した状態 |
|
POC |
Proof of Concept概念実証の略で、患者での安全性と有効性(治療効果)が確認されること |
|
PK |
Pharmacokinetics薬物動態の略で、薬物投与後の体内薬物濃度の推移 |
|
PD |
Pharmacodynamics薬力学の略で、生体や細胞に対する薬物の作用 |
|
PMDA |
Pharmaceuticals and Medical Devices Agency医薬品医療機器総合機構の略で、厚生労働省所管の独立行政法人であり、医薬品等の品質、有効性及び安全性の向上に関する審査機関 |
|
非臨床試験 |
臨床試験以外の試験であり、臨床試験を行う前に実施する安全性試験、薬物動態試験、薬効薬理試験などが含まれる。 |
|
ファーストインクラス |
これまでになかった新しい作用を有する低分子の画期的医薬品のカテゴリーのことで、既存治療薬による治療法を大きく変えることができる可能性のある医薬品のこと |
|
B細胞シグナル、T細胞シグナル |
リンパ球であるB細胞やT細胞の増殖を活性化するシグナル |
|
BTK |
Bruton’s Tyrosine Kinaseの略で、対象となるタンパク質にリン酸基を転移させる反応を触媒する酵素 |
|
ブロックバスター |
画期的な薬効を持つ新薬で、大きな売上を生み出す医薬品(年商1,000億円以上の製品を指すことが多い) |
|
分子標的薬 |
特定の生体分子を標的として、その機能を制御する医薬品 |
|
MALT1 |
Mucosa-Associated Lymphoid Tissue lymphoma translocation protein 1の略で、タンパク質を切断する酵素のひとつ |
|
薬物動態 |
薬物投与後の体内薬物濃度の推移、PK(Pharmacokinetics)のこと |
|
用量漸増コホート |
第1相臨床試験のなかで、最大耐量MTDや用量制限毒性DLTを確認するために症例を集めた患者集団のこと |
|
臨床試験 |
新しい医薬品などの効果や安全性について確認するために行われる患者を対象とした試験 |
|
臨床研究 |
病気の原因及び病態の理解ならびに予防方法、診断方法及び治療法の改善を目的として実施されるヒトを対象とする医学系研究の総称 |
4【関係会社の状況】
該当事項はありません。
5【従業員の状況】
(1)提出会社の状況
|
|
|
|
|
2024年3月31日現在 |
|
従業員数(人) |
平均年齢(歳) |
平均勤続年数(年) |
平均年間給与(円) |
|
|
|
( |
|
|
|
(注)1.従業員数は就業人員(当社から社外への出向者を除き、社外から当社への出向者を含む。)であり、臨時雇用者数(パートタイマー、人材会社からの派遣社員、季節工を含む。)は、最近1年間の平均人員を( )外数で記載しております。
2.平均年間給与は、賞与及び基準外賃金を含んでおります。
3. 当社の事業セグメントは医薬品事業のみの単一セグメントであるため、セグメント別の従業員の記載はしておりません。
(2)労働組合の状況
当社において労働組合は結成されておりませんが、労使関係は安定しております。
(3)管理職に占める女性労働者の割合、男性労働者の育児休業取得率及び労働者の男女の賃金差異
当社は、「女性の職業生活における活躍の推進に関する法律」(平成27年法律第64号)及び「育児休業、介護休業等育児又は家族介護を行う労働者の福祉に関する法律」(平成3年法律第76号)の規定による公表義務の対象ではないため、記載を省略しております。