第二部 【企業情報】
第1 【企業の概況】
1 【主要な経営指標等の推移】
(注)1.当社は連結財務諸表を作成しておりませんので、連結会計年度に係る主要な経営指標等の推移については記載しておりません。
2.mRNA低分子創薬プラットフォーム事業を立ち上げ、さらに事業収益を拡大させるため、当社プラットフォーム事業の強化を目的とした研究開発費の増加、及び事業拡大に伴う人件費等の販売費及び一般管理費の増加により、第3期から第7期は経常損失及び当期純損失を計上しました。
3.持分法を適用した場合の投資利益については、関連会社がないため記載しておりません。
4.当社は、A種優先株式について、2017年5月31日付で480,768株、2017年8月31日付で109,889株、合計して590,657株を有償第三者割当により増加しております。また、B種優先株式について、2019年3月29日付で444,444株、2019年4月15日付で55,556株、合計して500,000株を有償第三者割当により増加しております。また、C種優先株式について、2021年12月24日付で560,000株を有償第三者割当により増加しております。
5.潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、当社株式は非上場であり、期中平均株価が把握できないため、また、1株当たり当期純損失であるため記載しておりません。
6.自己資本利益率については、第3期から第7期は当期純損失であるため記載しておりません。
7.株価収益率は当社株式が非上場であるため記載しておりません。
8.1株当たり配当額及び配当性向については、配当を実施していないため記載しておりません。
9.第3期、第4期及び第5期についてはキャッシュ・フロー計算書を作成していないため、キャッシュ・フローに係る各項目については記載しておりません。
10.mRNA低分子創薬プラットフォーム事業による事業収益を拡大させるため、当社プラットフォーム事業の強化を目的とした研究開発費の増加、及び事業拡大に伴う人件費等の販売費及び一般管理費の増加により、第6期から第7期は営業活動によるキャッシュ・フローがマイナスになりました。
11.当社プラットフォーム事業の強化のため、BLI装置を購入したため、第7期は投資活動によるキャッシュ・フローがマイナスになりました。
12.臨時従業員の総数が従業員の100分の10未満である事業年度については、平均臨時雇用者数の記載を省略しております。
13.主要な経営指標等の推移のうち、第3期から第5期については会社計算規則(平成18年法務省令第13号)の規定に基づき算出した各数値を記載しており、金融商品取引法第193条の2第1項の規定による監査を受けておりません。
14.第6期及び第7期の財務諸表については、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、東陽監査法人により監査を受けております。
15.「収益認識に関する会計基準」(企業会計基準第29号 2020年3月31日)等を第7期の期首から適用しており、第7期に係る主要な経営指標等については、当該基準等を適用した後の指標等となっております。
16.2023年7月31日開催の臨時株主総会の決議により、定款の一部変更を行い、A種優先株式、B種優先株式及びC種優先株式に関する定款の定めを廃止し、同日付でA種優先株式590,657株、B種優先株式500,000株及びC種優先株式560,000株をすべて普通株式に変更しております。これにより発行済株式総数のうち普通株式が1,650,657株増加しております。また、2023年7月31日開催の取締役会決議により、2023年8月17日付で普通株式1株につき2株の株式分割を行っておりますが、第6期の期首に当該A種優先株式、B種優先株式及びC種優先株式から普通株式への変更並びに株式分割が行われたと仮定して1株当たり純資産額及び1株当たり当期純損失を算定しております。
17.2023年7月31日開催の臨時株主総会の決議により、定款の一部変更を行い、A種優先株式、B種優先株式及びC種優先株式に関する定款の定めを廃止し、同日付でA種優先株式590,657株、B種優先株式500,000株及びC種優先株式560,000株をすべて普通株式に変更しております。これにより発行済株式総数のうち普通株式が1,650,657株増加しております。また、2023年7月31日開催の取締役会決議により、2023年8月17日付で普通株式1株につき2株の株式分割を行っております。
そこで、東京証券取引所自主規制法人(現 日本取引所自主規制法人)の引受担当者宛通知「『新規上場申請のための有価証券報告書(Ⅰの部)』の作成上の留意点について」(平成24年8月21日付東証上審第133号)に基づき、第3期の期首にA種優先株式、B種優先株式及びC種優先株式から普通株式への変更並びに株式分割が行われたと仮定して算定した場合の1株当たり指標の推移を参考までに掲げると以下のとおりとなります。なお、第3期、第4期及び第5期の数値については、東陽監査法人の監査を受けておりません。
2 【沿革】
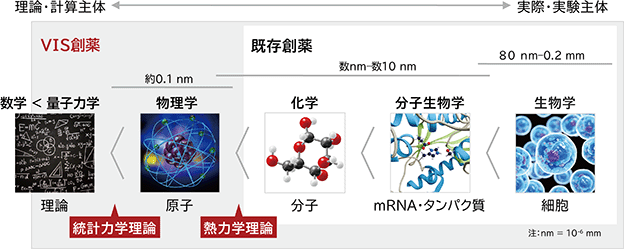
当社の創業者である中村慎吾は、2000年代初頭に米国エール大学で行った最新のRNA※1生物学研究に発想を得て、武田薬品工業株式会社(以下「武田薬品」という)在職中の2004年、「メッセンジャーRNA(mRNA)※2を標的とする低分子創薬」の実現を目指すプロジェクトを立ち上げました。会社の方針転換によるプロジェクトの中断を受けて2011年に武田薬品を退職するにあたり、在職中の研究成果を武田薬品より譲り受けた後、改めて最新の科学に基づきRNA構造を研究する統計力学※3理論及び熱力学※4理論並びにその理論を解析に応用する計算ソフトウェアなど、当該創薬を実現するための基礎技術を構築しました。中村はこれと並行して、医薬品ビジネス及び医薬品製造、さらにはベンチャービジネスへの投資や経営の実務経験を積む中、「mRNAを標的とする低分子創薬」を広く製薬会社へ提供することが製薬業界に共通する課題への解決策になると確信し、2016年11月に株式会社Veritas In Silicoを設立しました。
当社設立以降の変遷は、以下のとおりであります。
3 【事業の内容】
当社は、どんな疾患の患者様も治療法がないと諦めたり、最適な治療が受けられないと嘆いたりすることのない、そんな希望に満ちたあたたかい社会の実現に貢献するため、メッセンジャーRNA(mRNA)を標的とする低分子医薬品(以下「mRNA標的低分子医薬品」という)の創出に取り組んでいます。mRNAを標的とする低分子創薬(以下「mRNA標的低分子創薬」という)は、従来のタンパク質を標的とする創薬技術では狙えなかった様々な疾患にも対応可能な新しい創薬アプローチであり、アンメット・メディカル・ニーズ(有効な治療薬や治療法がなく未だ満たされない医療ニーズ)の充足につながることが期待されます。当社は、mRNA標的低分子創薬でより多くの医薬品を患者様にお届けするため、自社で少数のパイプライン※7を保有する「パイプライン型」のビジネスではなく、当社独自の創薬プラットフォーム「ibVISⓇ」(以下「ibVISⓇプラットフォーム」という)を活用し、複数の製薬会社と共同で創薬研究を実施する「プラットフォーム型」のビジネスを展開しています。
なお、当社のセグメントは創薬プラットフォーム事業のみの単一セグメントであります。
(1) 事業の背景
疾患の発症のメカニズムは多種多様ですが、主に疾患の原因となるタンパク質(以下「疾患関連タンパク質」という)の異常な働きによって引き起こされ、現在の医薬品市場は、直接疾患関連タンパク質に結合し、その機能を制御することで異常な働きを止める医薬品(低分子医薬品、抗体医薬品※8など)が主流です(図1)。しかし、これらの医薬品が創薬標的として狙うことのできる疾患関連タンパク質の数はもともと限られているため、長年にわたる医薬品の研究開発※9の結果、新薬開発が求められている医療ニーズの高い疾患に対して新たに医薬品を創出することが難しくなっています。このように、創薬標的となる疾患関連タンパク質が限られてきている現状、すなわち「創薬標的の枯渇」が、製薬業界共通の課題となっています。
mRNAは、DNA※10から特定のタンパク質に関する遺伝情報を書き写した設計図です。疾患関連タンパク質の設計図であるmRNAの機能を制御することができれば、疾患関連タンパク質の機能を直接医薬品で制御する場合と同様に、その疾患関連タンパク質が原因となる疾患を治療することが可能になり、「創薬標的の枯渇」の解決策につながることが期待されます(図1)。
mRNAを標的とする医薬品は、核酸医薬品(DNAやRNAといった遺伝情報を司る物質「核酸」そのものを利用した医薬品のこと)によって実現されています。しかし、核酸医薬品は経口投与が困難であるだけでなく製造コストが高く、市場の拡大には限界があると考えられます。当社は、低分子医薬品のように経口投与が可能で患者様の負担が少なく、開発・製造技術が確立している安価な医薬品でmRNA標的創薬を実現することが、製薬業界の真のニーズであり、mRNA標的低分子医薬品は今後の成長市場になる可能性があると考えております。それにもかかわらず、mRNA標的低分子医薬品はこれまでほとんど創出されておりませんでした。低分子創薬では、創薬標的全体の構造を精密に解析し、創薬標的上に低分子医薬品が結合して薬効を示すことが期待できる構造を最初に特定すること(このプロセスを、以下「ターゲット探索」という)が重要です。しかしながら、mRNAは1つの決まった構造をとらず、創薬研究を始める際に精密な構造の解析を行うことが困難であるため、mRNAを創薬標的にして低分子創薬を実施することは難しいという業界の常識がありました。このような状況において、当社の創業者である中村が2000年代前半より技術開発してきたインシリコ※11RNA構造解析技術により、mRNAを創薬標的としたターゲット探索が可能になり(詳細は「(2) 当社の事業領域 ② ibVISⓇプラットフォーム c mRNA標的低分子創薬を可能にするインシリコRNA構造解析技術」を参照)、ターゲット探索の結果を活用した実用的な低分子化合物のスクリーニング※12法(様々な化合物の中からある一定の基準を満たす化合物を選択するためのプロセス)と合わせて、当社の創薬プラットフォームの基礎となっています。
図1. 現在の主な医薬品市場(タンパク質標的医薬品)と当社が取り組む今後の成長市場(mRNA標的低分子医薬品)

(注) mRNA標的低分子医薬品の研究開発は世界的に見てもほとんどが研究段階であり、
本創薬で上市された低分子医薬品はありません(2023年11月末現在)。
現在の医薬品市場の中心の一つであるタンパク質標的低分子医薬品とその創薬標的であるタンパク質の関係は、ちょうど「鍵」と「鍵穴」の関係に例えられ、低分子創薬とは、創薬標的上に「鍵穴」を探索し、様々な工程(「鍵候補」を見つけるスクリーニングなど)を経て「鍵穴」にピタリとはまる「鍵」を創出する一連のプロセスであると言えます(図2)。
当社は、独自のインシリコRNA構造解析により、多くのmRNA上には局所的に低分子医薬品(「鍵」)が結合できる構造(「鍵穴」)があること(当社では、mRNA上に局所的に存在する構造を「部分構造」、そのうち標的として定める構造を「ターゲット構造」と呼んでおり、「鍵穴」は「ターゲット構造」に該当します)、しかも多くの場合、複数の「鍵穴」が存在することを見いだしました。また、これらの「鍵穴」に対して「鍵候補」を見つけるための独自改良したスクリーニング法の確立等により、タンパク質標的低分子創薬と同様に、新しい創薬アプローチであるmRNA標的低分子創薬の実施が可能になっています(図2)。
図2. 低分子創薬のターゲット探索(鍵穴の探索)とスクリーニング(鍵候補を見つけるプロセス)
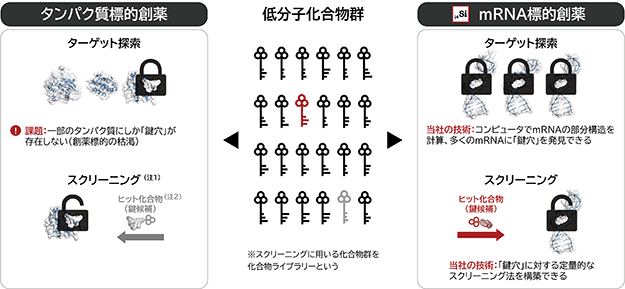
(注1) 様々な化合物の中から一定の基準を満たす化合物を選択するためのプロセス(鍵穴に対して鍵候補を見つけるプロセス)
(注2) スクリーニングで一定の基準を満たした化合物(鍵候補)
mRNA標的低分子創薬は、当社のインシリコRNA構造解析の技術を用いることにより、新薬開発のニーズが高いにもかかわらず、タンパク質を標的とした従来創薬ではこれまで医薬品の研究開発が不可能もしくは困難であった様々な疾患に適用できる潜在性を秘めており、疾患関連タンパク質において大きな割合を占めるブルーオーシャン(競争相手のいない又は競争相手の少ない未開拓な市場)を開拓できる創薬アプローチであると考えております(図3)。患者様、製薬業界、そして経済的観点から社会に望まれている低分子医薬品の創出に取り組むことができることから、mRNA標的低分子創薬は次世代創薬の本命の一つとして期待されています(詳細は「第2 事業の状況 1 経営方針、経営環境及び対処すべき課題等 (4) 経営環境」を参照)。
図3. mRNA標的低分子創薬によりブルーオーシャンの開拓を目指す
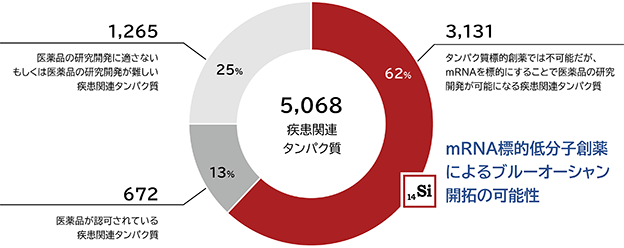
出典:The Human Protein Atlas, DrugBank, KS analysis, 2018 をもとに当社にて作成
(2) 当社の事業領域
当社は、インシリコRNA構造解析技術をはじめとしたデジタル技術(informatics)と創薬技術(biology)を統合したibVISⓇプラットフォームを活用したmRNA標的低分子創薬を主事業としており、製薬会社との共同創薬研究を通じて、mRNA標的低分子医薬品の創出に取り組んでいます(図4)。
また、将来の事業の多角化のため、インシリコRNA構造解析技術を応用した各種RNA関連創薬の取り組みも開始しています(図4)。
図4. Veritas In Silicoの事業領域
① mRNA標的低分子創薬
a mRNA標的低分子医薬品の作用メカニズム
私たちの体は、各部位の機能に応じて、その機能を発揮するために必要なタンパク質で構成されています。各部位の細胞内では、細胞の核の中にあるDNAがもつ全ての遺伝情報から、各部位に必要なタンパク質の遺伝情報のみがmRNAに書き写されます(転写)。mRNAは核内から外に運び出された後、書き写されたタンパク質の遺伝情報を設計図として、リボソーム※13というタンパク質合成機構に遭遇することでタンパク質の合成が開始されます(翻訳)。タンパク質の翻訳の際、まずリボソームがmRNAの一方の端(5'末端)に取り付き、このリボソームがもう一方の端(3'末端)に向かって進行しながらmRNAの遺伝情報を読み取り、20種類のアミノ酸(タンパク質の構成要素)の中から遺伝情報に対応するアミノ酸をつなげていくことでタンパク質が生成されます(図5)。この時、mRNA上にある程度安定な構造があっても、通常ならリボソームが構造をほどいて翻訳していきますが(図5左)、より強固でほどけにくい構造がmRNA上にある場合には、リボソームによる翻訳反応の進行が妨げられます(図5右)。
当社のmRNA標的低分子創薬は、mRNA上にある程度安定で低分子医薬品が結合できそうな部分構造を見いだしてターゲットとし、そのターゲット構造に結合し安定化する低分子医薬品によって、mRNA上により強固でほどけにくい構造体を意図的に構築させることで、リボソームによるタンパク質の翻訳を阻害もしくは制御することを狙っています。これにより、疾患の原因となる疾患関連タンパク質の生成を抑えられれば、従来の低分子医薬品や抗体医薬品等で直接疾患原因タンパク質の機能を阻害もしくは制御する場合と同等の効果が得られると考えられます。
図5. mRNA標的低分子医薬品の作用メカニズム
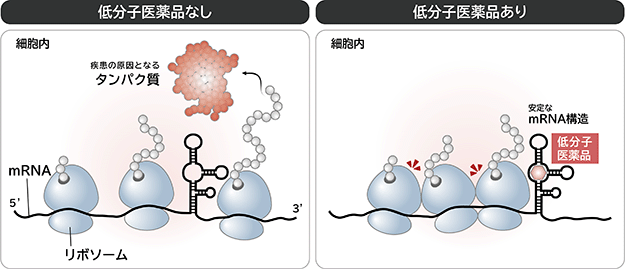
(注) 通常、ある程度安定なmRNA構造があっても、リボソームは構造をほどいてタンパク質を合成する。ある程度安定なmRNA構造が低分子医薬品によってより安定で強固になると、リボソームは構造をほどけずタンパク質の合成がストップする。
b mRNA標的低分子創薬の特徴 ― 研究開発 ―
一般的に医薬品の研究開発は、創薬標的を決定した後、医薬品候補化合物※14を創出するまでの創薬研究(研究段階)後、非臨床試験、臨床試験、承認取得(開発段階)完了までに長い年月を要します(表1)。当社が製薬会社と実施しているmRNA標的低分子創薬では、タンパク質を標的とした従来の低分子創薬と創薬標的は異なりますが、最終目的物は同じ化学的特性をもつ低分子化合物であることから、表1に示す創薬研究以外の非臨床試験、臨床試験、承認審査、さらには承認後の製造・販売で必要となる技術及びインフラは従来の低分子創薬と共通しています。mRNA標的低分子創薬で臨床試験以降の開発に進んでいる例は世界的にみてもまだありませんが、化学的特性がタンパク質標的低分子創薬の医薬品候補化合物と同等であることに鑑みると、開発以降のリスクや成功確率は概ねタンパク質標的低分子創薬の医薬品候補化合物と同程度であると考えられます。また、低分子医薬品の場合には開発ガイドラインも確立されているため、開発段階以降の障壁は他の新規創薬技術と比較して小さいと考えられます。
以上のことから、mRNA標的低分子創薬で重要なのは、医薬品として十分な効果・安全性等を示す医薬品候補化合物を創出するまでの創薬研究であると言えます。
表1. 一般的な医薬品の研究開発プロセス
(注1) 研究は、医薬品として十分な効果・安全性等を示す医薬品候補化合物を創出するまでの段階
(注2) 開発は、創薬研究で取得した医薬品候補化合物の効果・安全性等を規制当局に証明していく段階
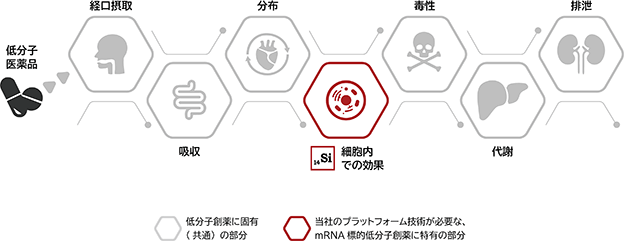
c mRNA標的低分子創薬の特徴 ― 薬物動態・安全性 ―
医薬品の創薬研究では、タンパク質標的低分子医薬品の場合には疾患関連タンパク質の機能を抑制する効果など、医薬品の主作用(薬効)だけではなく、医薬品が投与されてから血中へ吸収されるか、血中から目的とする組織・細胞へ移行するかといった点や、医薬品が体内で代謝や排泄される過程、さらには安全性を確保するための毒性の低減、といった様々な課題について検討し、最適化する必要があります(医薬品を投与してから「吸収」「分布」「代謝」「排泄」される過程を「薬物動態」という)。
mRNA標的低分子創薬の創薬研究においても同様に薬物動態や安全性等の検討・最適化が必要ですが、タンパク質標的低分子医薬品と比べてmRNA標的低分子創薬の研究過程に特有の検討課題は、細胞内で標的とするmRNAに作用して疾患関連タンパク質を減少させられるかという「細胞内での効果」の工程のみであり、それ以外はタンパク質標的低分子創薬と共通しています(図6)。つまり、創薬研究段階におけるmRNA標的低分子創薬の新規創薬技術として特有のリスクは、概ね「細胞内での効果」が得られるか、という点になります。もちろん他の工程にもリスクはありますが、そのリスクはタンパク質標的低分子創薬と同様であると考えられ、この点については、長年の創薬研究を通じて各製薬会社には技術やノウハウが豊富に蓄積されています。逆に言うと、「細胞内での効果」は十分にあっても、mRNA標的低分子創薬特有ではない薬物動態や安全性により、創薬研究が中断するリスクがあるため、かかるリスクに対応した上でmRNA標的低分子創薬により患者様に医薬品を届ける観点からは、長年の創薬研究を通じて蓄積された各製薬会社の技術やノウハウが重要であると考えられます。当社ではこのリスクを鑑み、mRNA標的低分子創薬により患者様に医薬品を届けるためには、より多くの製薬会社と共同創薬研究を実施することが重要であると考え、「プラットフォーム型」のビジネスに注力しています(詳細は「(3) ビジネスモデルの特徴」を参照)。
当社と製薬会社とのibVISⓇプラットフォームを活用した共同創薬研究において、当社が担当するのは表1の創薬研究の中でも標的とする「細胞内での効果」に関するもの(「ターゲットの探索」「スクリーニング」「ヒット化合物検証」「リード化合物最適化」で構成される。詳細は「② ibVISⓇプラットフォーム b ワンストップで医薬品候補化合物まで取得」を参照)であり、それ以外の薬物動態や安全性研究、動物を用いた化合物の効果を検証するための実験、非臨床試験以降の開発段階については、タンパク質標的低分子創薬での経験や知見が豊富な提携先の製薬会社にて実施されます(製薬会社との役割分担の詳細は、「② ibVISⓇプラットフォーム b ワンストップで医薬品候補化合物まで取得」を参照)。
図6.低分子医薬品の創薬研究で検討が必要な課題
② ibVISⓇプラットフォーム
a 多種多様な疾患に適応可能
当社は、これまで国内外の多くの製薬会社に、当社のibVISⓇプラットフォームの創薬技術及びデジタル技術を紹介してきました。これらの製薬会社より、ibVISⓇプラットフォームでmRNA標的低分子創薬を実施したいと開示をうけた創薬対象遺伝子(Gene of Interest;GOI)の数は既に100を超え、そこから推定される疾患領域は、がん領域、中枢神経、各種希少疾患の順に多く、その他は循環器疾患、免疫疾患、感染症など多種多様です(図7)。これは、製薬会社という創薬の専門家から見て、ibVISⓇプラットフォームが様々な疾患に適応可能であると考えられていることを示唆していると当社では考えております。中でも市場の大きいがん領域の割合が突出しており、医薬品が血液脳関門(神経細胞に影響のある物質をブロックする保護システム。Blood Brain Barrier;BBB)を通過する必要のある中枢神経疾患の割合ががん領域に続いております。これらは、製造コストが低く巨大な市場にも供給可能であり、BBBを通過できる低分子医薬品の強みを活かせる疾患領域であると考えられます。
図7. 創薬対象遺伝子(GOI)からわかるmRNA標的低分子創薬の適用疾患領域
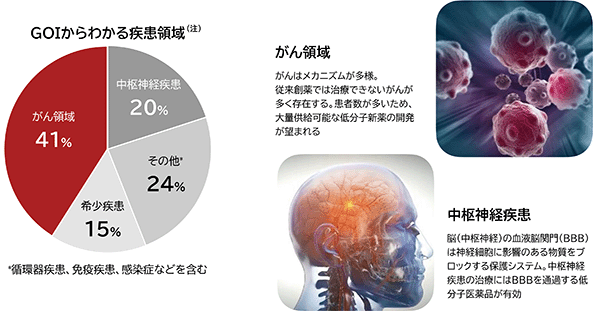
(注) 2023年11月末現在において製薬会社から開示されたGOIに基づき当社にて作成
b ワンストップで医薬品候補化合物まで取得
当社のibVISⓇプラットフォームは、mRNA上に存在する低分子医薬品の「鍵穴」の候補となる部分構造を網羅的に解析し、その中から標的に適した「鍵穴」すなわちターゲット構造を定める「ターゲット探索」から、数万から数十万の低分子化合物の中からターゲット構造に対して結合が認められる化合物を実験的に選択する「スクリーニング」、スクリーニングで取得したヒット化合物※15とターゲット構造の結合の強度や結合の特徴を詳細に検証する「ヒット化合物検証」、ヒット化合物検証により取得したリード化合物※16を医薬品レベルにまで効果を高める「リード化合物最適化」により、最終的に非臨床試験以降に進める医薬品候補化合物を取得するまで、mRNA標的低分子創薬に必要な全ての創薬技術とデジタル技術を備えていると当社は考えております(図8、表2)。さらに、それらの創薬技術とデジタル技術が単に個々の技術としてではなく、一つの創薬システムとして統合されており、各製薬会社はibVISⓇプラットフォームを活用することで、mRNA標的低分子創薬で直面する多くの課題をワンストップで解決することが可能になると当社は考えております。特に当社の「ターゲット探索」は、独自のデジタル技術を活用したインシリコRNA構造解析により、製薬会社が任意に選択したmRNAから高速かつ正確に複数のターゲット構造を探索することが可能であり、当社の競争優位性の一つとなっています。
図8. 創薬技術とデジタル技術を備えたワンストップ創薬プラットフォーム
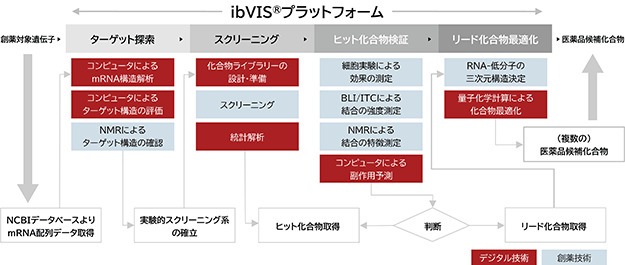
(注)製薬会社は、当社が技術供与したスクリーニング法を使ったスクリーニングの実施及び細胞実験を主に担当します。
加えて製薬会社側では、化合物の合成展開※17、薬物動態及び安全性研究、化合物の効果を検証する動物実験などが実施されます。
表2. ibVISⓇプラットフォームの創薬技術とデジタル技術
c mRNA標的低分子創薬を可能にするインシリコRNA構造解析技術
mRNAは分子内で相互作用して立体構造をとる巨大分子であり、細胞内の環境下では1つの決まった立体構造をとらず、様々なパターンの構造をとってそれらが混在するという性質があります。よって、一般的に一定の構造をとるタンパク質を標的とする既存創薬と同様の理論では、mRNA標的低分子創薬を実現することはできませんでした。
当社の中村は、約20年にわたる創薬研究の経験に基づき、1つの決まった状態をとらない事象を取り扱う統計力学理論及び熱力学理論がmRNAの性質を解析する上で有用な方法であることを見出しました。具体的には、統計力学理論によりmRNA上に局所的に存在する部分構造の存在確率を計算し、熱力学理論により各部分構造のエネルギー状態の計算から安定性・不安定性を評価します。このように、既存創薬の研究領域(化学~生物学)に統計力学理論及び熱力学理論を適切に応用することにより、mRNA上の各部分構造を存在確率や安定性・不安定などの各指標にもとづき定量的に評価する方法論を確立し、その結果、mRNA上にはいつも同じ構造を取ろうとする安定な部分構造が存在することを明らかにしました(図9)。
図9. mRNA標的低分子創薬実現への突破口
当社は、これらの方法論を実装した当社独自のRNA構造解析ソフトウェア「MobyDickⓇ」により、任意のmRNAから高速で網羅的に部分構造を発見し、低分子医薬品の標的に適したターゲット構造(一般的に、存在確率が高く安定であり、低分子化合物の結合が期待される部分構造)を定量的な評価にもとづき特定できるという強みを持っています。このターゲット探索の強みを活かして、製薬会社の幅広い創薬ニーズに応えるmRNA標的低分子創薬を可能にしています。
d 高い達成率を誇るターゲット探索とスクリーニング
当社のibVISⓇプラットフォームは、ターゲット探索とスクリーニングにおいて高い達成率を誇っています。製薬会社との共同創薬プロジェクトでは、これまでに製薬会社が選定したがん、中枢神経疾患、感染症等に関連するmRNAに対してターゲット探索を実施し、ターゲット探索で得られたターゲット構造に対して数万から数十万の化合物ライブラリーを使用した高速・高感度スクリーニング(qFRET)を実施しました。その結果、ターゲット探索の達成率は約97%(39個中38個のmRNAでターゲット構造を複数同定)、スクリーニングの達成率は約98%(48個のターゲット構造に対してスクリーニングを実施し、47スクリーニングで当社が定義するヒット化合物を複数取得)であり(図10)、結果的に創薬対象とするmRNAの選定から約95%の成功率でヒット化合物を取得しています(2023年11月末現在)。
図10. 高い達成率を誇るibVISⓇプラットフォームのターゲット探索とスクリーニング

(注1) ターゲット探索の図中のターゲット構造はイメージであり、実際の創薬研究で用いているターゲット構造ではありません。
(注2) ターゲット探索とスクリーニングの達成率は2023年11月末現在のものです。
e ヒット化合物検証(細胞実験)
ヒット化合物を得た後は、化合物の「細胞内での効果」を確認するため、細胞実験にてヒット化合物が対象となる疾患関連タンパク質の発現量に与える影響を確かめます。これまでの製薬会社との共同研究では、様々なヒット化合物が細胞実験により対象となる疾患関連タンパク質を減少させている、すなわち「細胞内での効果」を示す結果が得られています(図11)。この効果を示す化合物の濃度はまだ医薬品としては十分ではありませんが、この後の医薬品候補化合物の取得を目指した合成展開を開始するのに十分なスタート地点であると当社は考えております。また、こうしたヒット化合物の特性は、ibVISⓇプラットフォームの創薬技術に含まれるBLI/ITCによる結合の強度測定やNMRによる結合の特徴測定によっても確認されます。
図11.スクリーニングにより取得したヒット化合物の細胞内での効果検証(細胞実験結果)
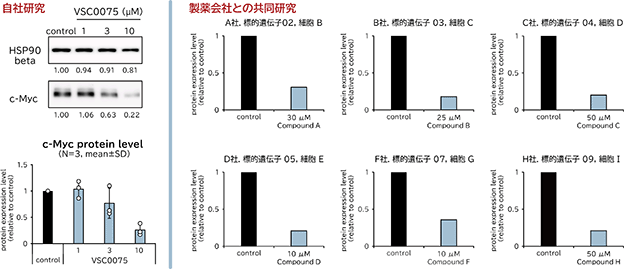
左図:疾患関連タンパク質(c-Myc)のmRNA上に発見したターゲット構造に対してスクリーニングで取得した化合物(VSC0075)を細胞に
添加することで、細胞内のc-Mycタンパク質量が下がっている(一般的なタンパク質の代表であるHSP90 betaにはほとんど影響がない)。
右図:製薬会社のうち6社について、スクリーニングで取得した化合物(Compound A-H)の細胞実験結果をそれぞれ一例ずつ示している。
③ その他のmRNA関連創薬の取組み
当社のインシリコRNA構造解析は、mRNA標的低分子創薬のターゲット探索だけではなく、mRNAの構造を詳細に解析できるという一般性から様々な創薬への応用が可能であると考えております。当社は、事業の安定性を担保する観点から、主事業のmRNA標的低分子創薬に続く将来事業を準備しています。
具体的には、これまで理論的な配列設計が困難とされてきた核酸医薬品の一種であるアンチセンスオリゴヌクレオチド(ASO)※28の配列設計にインシリコRNA構造解析を応用しております。当社のインシリコRNA構造解析により、短期間で医薬品候補化合物を取得でき(当社では最短8カ月で取得)、その結果研究開発費を抑えることが可能になると考えております。当社はこれまでに、ASOの創薬研究で医薬品候補化合物を獲得し、物質特許を取得した実績もあるため(詳細は「(4) プロジェクトの進捗状況 ③ その他プロジェクト(自社研究)」を参照)、将来的に社内でもパイプラインを保有する方針に転換(ビジネスモデル転換)する際には、低分子化合物と同様にASOを有力な自社パイプライン候補とすることを想定しています(詳細は「(3) ビジネスモデルの特徴 ④ ビジネスモデルの転換」を参照)。
このように、主事業及びASOの創薬研究を通じてmRNAについて深く理解し、インシリコRNA構造解析技術を向上させたことで、新型コロナウイルス感性症のmRNAワクチンに代表されるmRNA医薬品の体内での不安定性や凝集などの各種課題を解決する配列設計や、mRNA以外のRNA(以下「ncRNA」という)を標的とした創薬にもインシリコRNA構造解析技術の適用が可能になりました。これらmRNA医薬品とncRNA標的医薬品のプロジェクトも、初期的ではあるものの進行中であり(プロジェクトの進捗は「(4) プロジェクトの進捗状況 ③ その他プロジェクト(自社研究)」を参照)、製薬会社等から共同研究や事業協力の申し出があれば将来的に当社事業として組み込むことを想定しています。
(3) ビジネスモデルの特徴
① ビジネスモデルの概要
当社は、より多くのmRNA標的低分子医薬品を迅速に社会に届けるため、製薬会社の幅広いニーズに応える汎用性の高いibVISⓇプラットフォームを武器として、複数の製薬会社と多数の共同創薬プロジェクトを同時に進行させる「プラットフォーム型」のビジネスを展開しています(図12)。製薬会社との契約では、契約一時金、研究支援金にとどまらず、マイルストーン、ロイヤリティ等の対価を規定することにより、契約締結直後から長期的かつ継続した事業収益の確保を目指します。当社のようなバイオテク企業にとって、複数の共同創薬プロジェクトを同時進行するプラットフォーム型ビジネスは、安定した事業収益を確保する観点や、製薬会社との提携によってmRNA標的低分子医薬品の潜在的な市場のシェアを確保して数多くの医薬品を患者様にお届けする観点から、合理的なビジネスモデルであると考えております。
当社は現時点において、このプラットフォーム型ビジネスのもと、主な事業収益の源泉となる製薬会社との共同創薬プロジェクトを効率的に進めるため、アカデミアとの共同研究をはじめ、各種機関・企業と業務提携を結んでいます(図13)。
図12. 創薬系バイオテク企業のビジネスモデル

図13. Veritas In Silicoの事業系統図
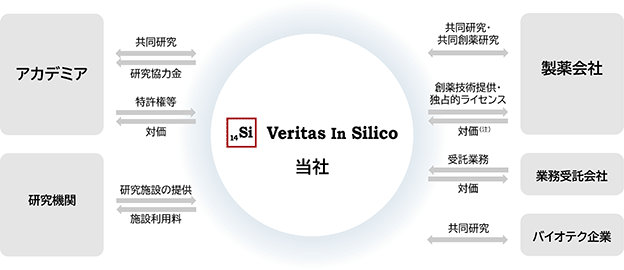
(注) 製薬会社から当社への対価の詳細は下記「②契約形式」をご参照ください。
② 契約形式
当社は、製薬会社と医薬品候補化合物を取得するまでの創薬研究を共同で実施する共同創薬研究契約を締結することを基本としています(図14)。共同創薬研究契約では、製薬会社から創薬対象とするmRNA(標的遺伝子)の情報を受領後、その標的遺伝子ごとにプロジェクトを設定し、各プロジェクトの進捗状況に応じて一連の継続的な事業収益が得られるように規定しています(図14、表3)。
当社と製薬会社の共同創薬研究契約に基づくパートナーシップ(以下、当社と共同創薬研究契約等に基づき、共同で創薬研究を実施する製薬会社を「パートナー」という)は、当社技術を用いて当社とパートナーが共同で医薬品候補化合物を創出する創薬研究段階と、医薬品候補化合物の創製における当社貢献部分をパートナーに譲渡し、パートナーが医薬品候補化合物の開発・販売を行うことで、当社に事業収益が発生する開発・販売段階で構成されます(図14)。各段階において当社が計上する主な事業収益は以下の通りです。
図14. Veritas In Silicoの収益構造
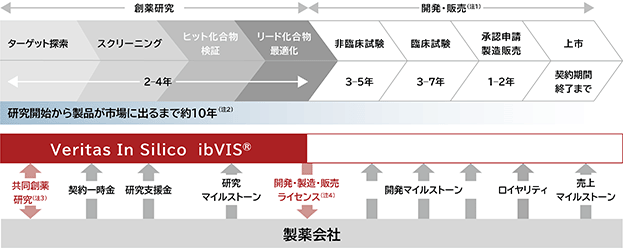
(注1) 現時点(2023年11月末現在)、当社と製薬会社との協業から製薬会社による開発・販売段階にまで進んだ実績はありません。
(注2) 上市までの期間については、実際の研究開発状況により大きく異なる可能性があります。
(注3) ibVISⓇプラットフォームを使用した当社と製薬会社の協業は、創薬研究期間中に限られます。
(注4) 開発・製造・販売ライセンスに関する取り決めについては、共同創薬研究契約に盛り込まれる場合もあります。
表3. 主な事業収益の内容
a 創薬研究
当社の共同創薬研究契約では、通常締結時にibVISⓇプラットフォームの使用に対する技術アクセスフィー等として「契約一時金」をパートナーより受領します。研究開始後、研究実施に対する費用支援・対価等として標的遺伝子ごとに設定された「研究支援金」を研究期間中毎年受領します。また、創薬研究中に追加的な研究が必要となる場合には、追加の「研究支援金」を標的遺伝子ごとに受領します。さらに、パートナーと事前にいくつかの研究達成目標、すなわちマイルストーンを設定し、当該マイルストーンを達成した場合には、パートナーより「研究マイルストーン」を受領します。
b 開発・販売
当社の共同創薬研究契約では、基本的に、創薬研究における成果の当社貢献度に基づき、当社が開発・販売において受領する「開発マイルストーン」、「ロイヤリティ」、「売上マイルストーン」等の経済条件についても以下のとおり規定しています。
創薬研究で医薬品候補化合物を取得し、パートナーにより非臨床試験に進む判断がされた場合には、当社はこの段階で、最初の「開発マイルストーン」を受領します。その後、医薬品候補化合物の開発はパートナーに委ねられますが、パートナーによる開発が進み、臨床試験に移行した場合には、臨床試験の段階ごとに追加的に「開発マイルストーン」を受領します。さらに、最終的に医薬品として上市された場合には、売上金額に一定の料率を乗じて得られる金額を「ロイヤリティ」として受領します。加えて、上市された医薬品の年間の売上高が所定の売上額に達した場合には、「売上マイルストーン」を受領します。
なお、2023年11月末現在において、当社とパートナーとの共同創薬研究は全て創薬研究段階であり、パートナーが単独で実施する開発・製造・販売にまで進んだ実績はありません。
③ 知的財産戦略(特許及びソフトウェア著作権)
当社は、ibVISⓇプラットフォームの「ターゲット探索」と「スクリーニング」の特許による権利化と、各種自社製作ソフトウェアで構成されるデジタル技術の秘匿化により、プラットフォーム全体の独占性を二重に担保しています(図15)。
特許「RNAの機能を制御する化合物のスクリーニング方法」により権利化した技術は、デジタル技術の「MobyDick2D」と創薬技術の「qFRET」です。主に、これらの技術を利用するibVISⓇプラットフォームの「ターゲット探索」と「スクリーニング」では、権利化した特許によって他社の利用を排除でき、当社の優位技術として製薬会社に活用いただいています。
創薬研究の各プロセスは、当社が独自開発し継続的にアップデートしている大量のデータ解析や実験のサポートをする自社ソフトウェアを使用することにより、はじめて実施可能となります。また、各プロセスに導入しているこれらデジタル技術により、並列処理による効率化と精度の高い創薬の実現にくわえ、製薬会社のニーズに応じた技術移転を容易とすることで、スケーラブルな創薬が可能になっています。
図15. ibVISⓇプラットフォームに係る知的財産権及び自社製作ソフトウェアによる独占性の担保
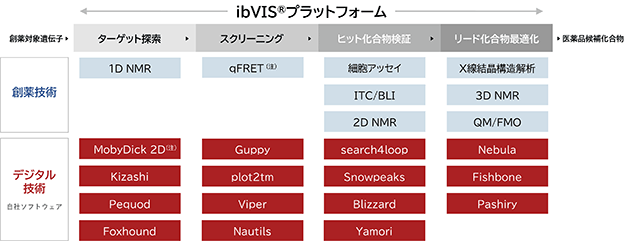
(注) 特許6781890号 RNAの機能を制御する化合物のスクリーニング方法
④ ビジネスモデルの転換
当社は、mRNA標的低分子創薬の潜在的な市場のシェアをある程度確保した後に、プラットフォーム型ビジネスにくわえ、自社でパイプラインの開発も進めるハイブリッド型ビジネスへの転換を計画しています。プラットフォーム型ビジネスによりパートナー数を増やし、パートナーから中長期的に充分な収益が見込めるようになった段階(当社では2026年頃と想定)で、自社パイプラインの開発を開始することを目指しますが、当面は、開発の早い段階で製薬会社にライセンスアウトする方針です。
自社パイプラインの候補としては、「(4) プロジェクトの進捗状況 ② mRNA標的低分子創薬のプロジェクト(自社研究) ③ その他プロジェクト(自社研究)」のmRNA標的低分子医薬品及び核酸医薬品のプロジェクトのほか、当社では核酸医薬品の医薬品候補化合物を取得するまでに要する期間が最短8か月と短いことから、新規の核酸医薬品のプロジェクトも自社パイプラインとして有力な候補になると考えています。
(4) プロジェクトの進捗状況
① mRNA標的低分子創薬のプロジェクト(共同創薬研究)
mRNA標的低分子創薬のプラットフォーム型ビジネスを展開する当社は、多額の開発費を投入して少数の自社パイプラインを育てる代わりに、共同創薬研究のパートナー数を増やすとともに、各パートナーとのプロジェクトを進捗させることで、相乗的な事業拡大を図っています。当社はこれまでに、プラットフォーム型ビジネスの特徴を活かしたパートナーとの共同研究を通じてibVISⓇプラットフォームの技術力向上を達成し、より高収益の共同創薬研究契約の締結が可能になりました(図16)。現在、共同創薬研究のパートナー4社(東レ株式会社、塩野義製薬株式会社、ラクオリア創薬株式会社、武田薬品工業株式会社)とのプロジェクトが進捗しています。
図16. プラットフォーム型ビジネスを活用した技術力向上と事業拡大
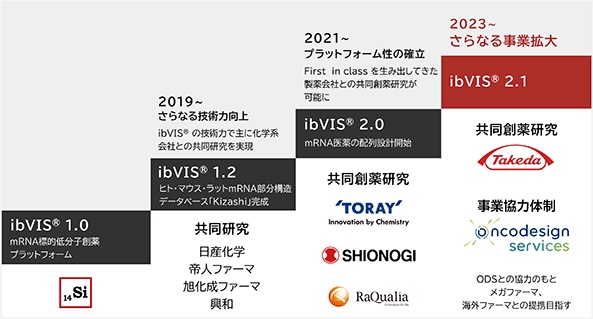
(注) Oncodesign ServicesとはMOUのもと新規顧客獲得で協力関係にありますが、具体的な事業提携はしておりません(2023年11月末現在)。今後は、Oncodesign Servicesの医薬品開発業務受託機関(CRO)としての実力や実績を活かし、新規顧客獲得の協力にとどまらず、既存及び新規共同創薬研究のパートナーの創薬ニーズへの対応や、当社の将来の自社パイプラインの準備等で本格的に事業提携することを想定しています。
共同創薬研究中のパートナー4社とのプロジェクトが進捗しており、4社とのプロジェクト中で最も進んでいるプロジェクトは、現在「ヒット化合物検証」を実施中の段階です(図17)。
図17. 共同創薬研究中の製薬会社のプロジェクト進捗状況

(注1) 製薬会社との共同創薬プロジェクトは契約上守秘義務があるため、プロジェクトで対象としている疾患及び
経済条件については、一部記載を「非開示」としています。
(注2) 東レとの共同創薬研究では、医薬品候補化合物の権利は東レと当社で共有します。
当社は、共同研究及び共同創薬研究の契約にもとづき、これまでに合計5.5億円の事業収益を獲得しています(2023年9月末現在)。今後は、共同創薬研究中のパートナー4社との契約にもとづき、短期的(創薬研究期間中)には17.8億円(このうち5.5億円は取得済)の研究支援金又は研究マイルストーン、中期的(開発期間中)には80.5億円の開発マイルストーンを事業収益として獲得する可能性があります(図18)。さらに、医薬品が上市した場合には、長期的(販売期間中)に、1桁台前半パーセント(%)のロイヤリティ及び販売額に応じたマイルストーン収入(最大1,050億円)が見込まれます(図18)。ただし、東レの場合には、医薬品候補化合物の権利は東レと当社で共有することになっており、当社は化合物の持分に応じた収益を受領することになります。
なお、研究・開発・売上のマイルストーンについては、いずれも既存のプロジェクトが全て成功した場合の最大値を示しています。創薬の成功確率は相対的に高くはなく、現実的に全てのプロジェクトが成功するわけではなく、一部又は全部のプロジェクトが成功に至らない場合や、成功に至った場合であっても当初想定した売上が達成できない場合等には研究・開発・売上のマイルストーンが減少する可能性がある点に十分ご留意ください。
図18. 既存の共同創薬研究契約から得られる事業収益のポテンシャル
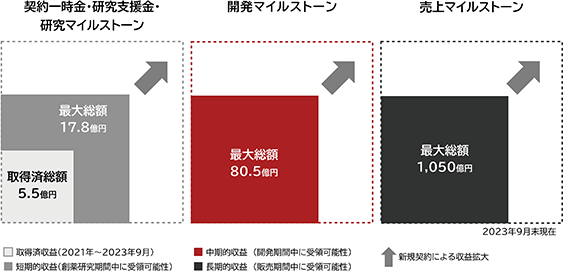
(注) 取得済総額は、共同研究により取得した収益を含みます。マイルストーンは、いずれも既存のプロジェクトが全て成功した場合の最大値を示しています。創薬の成功確率は相対的に高くはなく、現実的に全てのプロジェクトが成功するわけではない点に十分留意が必要です。
② mRNA標的低分子創薬のプロジェクト(自社研究)
mRNA標的低分子創薬は様々な疾患への応用展開が可能なことから、共同創薬研究開始後、パートナーあたりのプロジェクト数が積み上がる場合がある一方、パートナー側の社内優先順位等の関係で、一部のプロジェクトが中止される場合もあります。当社は、パートナーとの契約締結の際に開発・製造・販売ライセンスに関する取り決めを盛り込む場合を除き、中止されたプロジェクトの成果の当社への譲渡について契約書に規定することにより、自社プロジェクトへ転用することを可能にしています。実際に、中止されたプロジェクトのうち有望なプロジェクトについては自社プロジェクトに転用しており、事業開発や創薬プラットフォームの技術開発のために活用しています。
当社のmRNA標的低分子創薬のプロジェクトは、医療ニーズの高いがん領域が中心であり、将来的に当社のビジネスモデルをハイブリッド型に移行する際には、これらのプロジェクトが自社パイプラインの有力な候補になると考えております(図19)。現時点においては、一部のプロジェクトについて、事業開発や創薬プラットフォームの技術開発を目的とした社内研究を実施するにとどめており、具体的に自社パイプライン候補として進捗しているプロジェクトはありません(2023年11月末現在)。
図19. mRNA標的低分子創薬の自社プロジェクト進捗状況

(注1) 現時点(2023年11月末現在)、進捗しているプロジェクトはありません。
(注2) これらのプロジェクトは、製薬会社との共同創薬プロジェクトを当社の自社プロジェクトとして譲り受けたものです。
自社プロジェクトとして再開する際には、事業の自由度を確保するために改めてスクリーニングから実施する必要があります。
③ その他プロジェクト(自社研究)
当社は、希少疾患を中心に、将来のハイブリッド型ビジネスを見据えた核酸医薬品 (核酸医薬品の一種であるASO) のプロジェクトを保有しています。また、mRNA医薬品及びncRNA標的医薬品のプロジェクトは、現在基礎研究(ターゲット探索)を実施中です(図20)。
核酸医薬品のプロジェクトは、急性腎不全や脱毛症を対象疾患とした遺伝子p53に対するASO、及び東京慈恵会医科大学の岡野ジェイムス洋尚教授との共同研究により創出された、筋萎縮性側索硬化症(ALS)などの神経変性疾患を対象疾患としたASOであり、両プロジェクトともに医薬品候補化合物を取得して物質特許を出願し、p53のASOについては日本で特許が権利化されました。
mRNA医薬品(mRNA補充療法)では、タンパク質補充療法の実例があるファブリー病とハンター症候群に着目し、これら疾患の治療で補充すべきタンパク質の設計図となるmRNAをもとに、血中で安定し、自己凝集しないmRNA医薬の配列設計を開始しています。
ncRNA標的医薬品のプロジェクトとしては、ncRNAの中でも機能が解明され、多発性骨髄腫への関与がわかっているncRNAに対して、核酸医薬品を創出するプロジェクトを開始しています。
図20. 核酸医薬品、mRNA医薬品及びncRNA標的医薬品の自社プロジェクト進捗状況
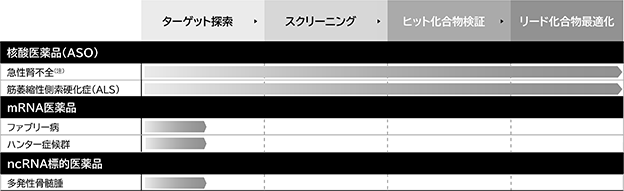
(注) 特許6934695号 核酸医薬とその使用
<用語解説>
4 【関係会社の状況】
該当事項はありません。
5 【従業員の状況】
(1) 提出会社の状況
2023年11月30日現在
(注)1.従業員数は、臨時従業員(パート職員)を除いた就業人員数であります。
2.平均年間給与は、賞与及び基準外賃金を含んでおります。
3.当社は創薬プラットフォーム事業の単一セグメントであるため、セグメント別の従業員数の記載はしておりません。
4.臨時従業員(パート職員)の総数が従業員数の100分の10未満であるため、平均臨時雇用者数の記載を省略しております。
(2) 労働組合の状況
労働組合は結成されておりませんが、労使関係は円満に推移しております。