第二部 【企業情報】
第1 【企業の概況】
1 【主要な経営指標等の推移】
(注) 1.当社は連結財務諸表を作成しておりませんので、連結会計年度に係る主要な経営指標等の推移については記載しておりません。
2.持分法を適用した場合の投資利益については、関連会社が存在しないため、記載しておりません。
3.第2期から第5期の潜在株式調整後1株当たり当期純利益については、1株当たり当期純損失であり、また潜在株式が存在していないため、記載しておりません。第6期の潜在株式調整後1株当たり当期純利益については、1株当たり当期純損失であり、また潜在株式は存在するものの、当社株式は非上場であり、期中平均株価が把握できないため記載しておりません。
4.1株当たり純資産額については、優先株主からの払込金額を控除して算定しております。
5.自己資本利益率については、当期純損失を計上しているため記載しておりません。
6.当社株式は非上場であるため株価収益率を記載しておりません。
7.1株当たり配当額及び配当性向については、配当を行っていないため記載しておりません。
8.第2期から第4期については、キャッシュ・フロー計算書を作成していないため、キャッシュ・フローに係る各項目については記載しておりません。
9.平均臨時雇用者数については、従業員数の100分の10未満であるため、記載しておりません。
10.第4期は、決算期変更により2019年11月1日から2020年12月31日までの14カ月間となっております。
11.主要な経営指標等のうち、第2期から第4期については会社計算規則(平成18年法務省令第13号)の規定に基づき算出した各数値を記載しており、金融商品取引法第193条の2第1項の規定による監査証明を受けておりません。
12.前事業年度(第5期)及び当事業年度(第6期)の財務諸表については、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、有限責任 あずさ監査法人により監査を受けておりますが、第2期、第3期及び第4期の財務諸表については、監査を受けておりません。
13.2023年6月1日付で、A種優先株主、B種優先株主及びC種優先株主の株式取得請求権の行使を受けたことにより、全てのA種優先株式、B種優先株式及びC種優先株式を自己株式として取得し、対価として当該A種優先株主、B種優先株主及びC種優先株主にA種優先株式、B種優先株式及びC種優先株式1株につき普通株式1株を交付しております。また、会社法第178条の規定に基づき2023年6月9日開催の取締役会決議により、同日付で当該種類株式を消却しております。なお、当社は2023年6月26日開催の臨時株主総会において、種類株式を発行する旨の定款の定めを廃止しております。
14.当社は、2023年7月19日開催の取締役会決議により、2023年8月6日付で普通株式1株につき、1,000株の割合で株式分割を行っております。第5期の期首に当該株式分割が行われたと仮定し、1株当たり純資産額及び1株当たり当期純利益を算定しております。
15.当社は、2023年8月6日付で普通株式1株につき1,000株の分割を行っております。
そこで、東京証券取引所自主規制法人(現 日本取引所自主規制法人)の引受担当者宛通知「『新規上場申請のための有価証券報告書(Ⅰの部)』の作成上の留意点について」(平成24年8月21日付東証上審第133号)に基づき、第2期の期首に当該株式分割が行われたと仮定して算定した場合の1株当たり指標の推移を参考までに掲げると以下のとおりとなります。
なお、第2期から第4期の数値(1株当たり配当額については全ての数値)について、有限責任 あずさ監
査法人の監査を受けておりません。
2 【沿革】
3 【事業の内容】
当社は、有効な治療法が確立していない神経難病に対して、当社取締役CSO(Chief Science Officer)兼慶應義塾大学医学部生理学教室教授の岡野栄之、及び当社取締役CTO(Chief Technology Officer)兼同大学医学部整形外科学教室教授の中村雅也を中心とした長年の基礎研究の成果を実用化し、一刻も早く臨床の現場に有効な治療法を届けるため、慶應義塾大学医学部発のベンチャー企業として、2016年11月に、「医療イノベーションを実現し、医療分野での社会貢献を果たします」を経営理念として、医薬品および再生医療等製品の研究・開発・製造・販売を事業目的として設立いたしました。
当社が事業の主要な対象としております中枢神経疾患領域につきましては、筋萎縮性側索硬化症(以下ALS *1)など我が国においても難病に指定される疾患が多く存在し、アルツハイマー病(*2)に代表される様々な認知症症状に対しても、有効な治療薬の開発が求められております。また、脊髄損傷(*3)や脳梗塞(*4)などの損傷疾患についても、未だ有効な治療法が確立しておりません。ALSの患者数は、世界では約33万人、国内では約1万人(出典:Clarivate Analytics データベース)と推定されている一方、脊髄損傷につきましては、国内の亜急性期の脊髄損傷(*5)患者数は年間約5千人(出典:総合リハビリテーション「疫学調査」2008年)、慢性期の脊髄損傷(*6)患者数は約10~20万人(出典:総合リハビリテーション「疫学調査」2008年)、脳梗塞の患者数は約130万人(出典:Clarivate Analytics データベース)とされております。
これらの対象患者に対して画期的なイノベーションの実現により有効かつ安全な医療成果を届けるため、当社におきましては、iPS細胞(*7)を活用したiPS創薬事業と再生医療事業のハイブリッドで慶應義塾大学医学部等の大学や研究機関と連携して研究開発を推進するとともに、バリューチェーン(*8)を構成する各企業とも連携して事業活動を推進しております。なお、当社は医薬品等の研究・開発・製造・販売の単一セグメントであります。
(1)当社の事業領域
当社は、中枢神経疾患領域に対して、iPS細胞を活用したiPS創薬と脊髄損傷等の神経損傷部位に移植する再生医療等製品の開発を主たる事業としております。
①はじめに
長年、中枢神経領域において、「神経は再生しない」という考え方が一般的でありましたが、当社の創業科学者兼取締役CSOである岡野栄之等の研究チームが、神経幹細胞のバイオマーカー(*9)である遺伝子「musashi」を発見し、世界で初めて、ヒト脳の中にも神経幹細胞(*10)が存在することを示したことにより、中枢神経領域の再生医療の可能性を見出し、臨床での神経再生が現実的なものとなってきました。
また、2007年に京都大学山中伸弥教授の研究グループがヒトの皮膚細胞からiPS細胞の樹立に成功したことにより、①iPS細胞を活用した細胞移植治療/再生医療、②iPS細胞による病態解明・薬効評価の可能性が示されました。そこで、慶應義塾大学において岡野栄之と中村雅也の研究チームは、脊髄損傷の治療に対してiPS細胞から分化誘導(*11)した神経細胞を活用する研究を開始し、また、岡野栄之の研究チームは、ALSの患者様由来のiPS細胞から樹立した神経細胞を活用したALS治療薬の開発に着手致しました。

②当社の優位性
当社は、当社取締役CSO兼慶應義塾大学医学部生理学教室教授の岡野栄之、及び当社取締役CTO兼同大学医
学部整形外科学教室教授の中村雅也を中心とした長年の基礎研究をもとに事業を展開しており、特に、当社の
事業領域である中枢神経疾患領域においては、アカデミアにおいて蓄積してきた知見を軸に、慶應義塾大学等
のネットワークを活用して、自社研究所において各種ノウハウや技術(iPS細胞から神経細胞に適切かつ効率的
に分化誘導することができる技術、創薬に適した表現型(*12)を構築するためのノウハウや技術、再生医療
として神経細胞に分化誘導し移植するためのノウハウや技術など)を活用して研究開発を推進しております。
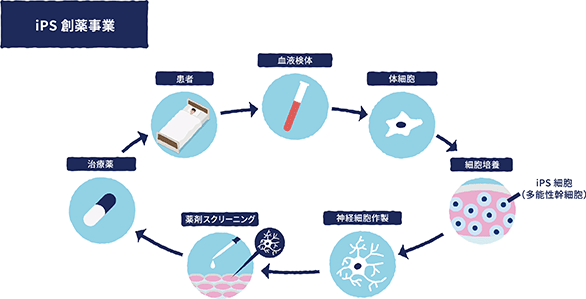
③iPS創薬事業
当社は、創薬の研究開発の手法として、病気の患者由来のiPS細胞から分化誘導した神経細胞を用いた表現型スクリーニングによる化合物・薬剤候補分子の効率的なin vitro(*13)スクリーニングを実施しております。具体的には、患者から提供を受けた細胞を用いて疾患の特異的な情報を有するiPS細胞を樹立したうえで、神経細胞に分化誘導し、既存の数多くある化合物ライブラリー(*14)の中から、当該iPS細胞から分化誘導した神経細胞に対する各表現型に関して、その量や機能的な活性や反応を定性的又は定量的に測定をすることで、薬剤の候補となる可能性のあるヒット化合物(*15)を選別しております。また、併せて、疾患の特異的な情報を有するiPS細胞から分化誘導した神経細胞を用いた疾患のメカニズムの解析や薬剤のターゲットとなりうる物質や遺伝子の解析等を共同研究先である慶應義塾大学医学部とともに進めております。
iPS創薬の手法は、従来の創薬開発プロセスにおける動物の疾患モデルでの評価を介さず、直接的にヒトの病態を反映した細胞を活用したものであることから、これまでの創薬開発プロセスより短期間で行うことが可能であり、かつ、前臨床の段階においてもヒトの細胞レベルでの病態の変化に対する評価を実施した上で臨床試験に進むことが可能であることから、当社では、アンメットメディカルニーズ領域(*16)の疾患に対して効率的かつ合理的に創薬を進めてまいります。
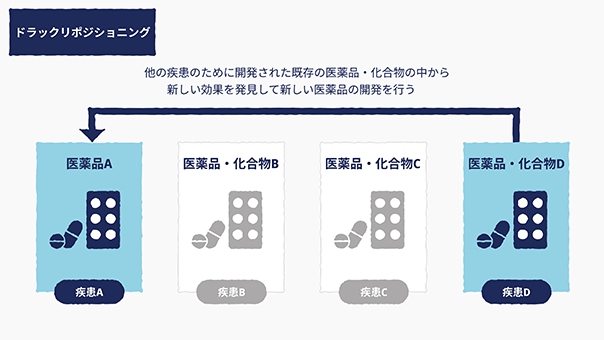
また、さらに、当社のiPS創薬は、他の疾患のために開発された既存の医薬品・化合物の中から、新しい効果を発見して新しい医薬品の開発を行う方法であるドラッグリポジショニングという創薬手法を活用することにより、新たに化合物を開発することがなく、特に既に上市された医薬品を用いる場合は、既にヒトに対して一定の安全性が確認されていることから、創薬の研究開発に係る費用や時間について、これまでの新薬開発に必要な期間を3~12年、費用を50~60%程度削減できる可能性がございます(出典:株式会社三菱総合研究所 2020.6 ドラッグリポジショニングによる創薬力の復活)。
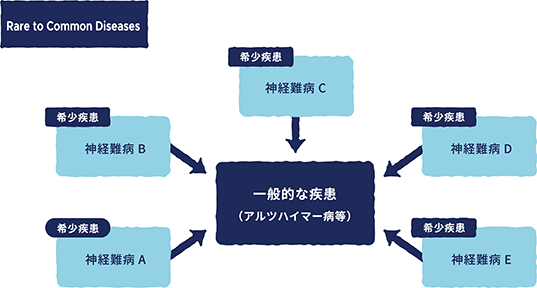
当社は、中枢神経疾患領域を重点ターゲットとして、未だ有効な治療法のない患者様に一刻も早く有効な治療法
を届けるため、ALSを始めとした難治性の希少疾患に対する開発パイプラインの研究開発を推進しておりますが、当
社といたしましては、各神経疾患が示す病態については一部共通した作用やメカニズムがあると考えていることか
ら、「Rare to Common戦略」(患者数が少ない難治性の疾患の創薬開発から、患者数の多い一般的な疾患の創薬開
発を目指す戦略)を推進してまいります。
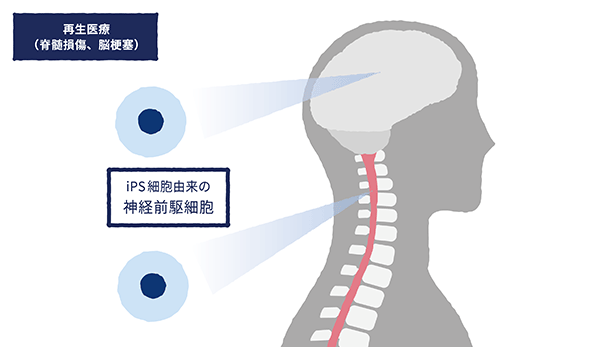
④再生医療事業
当社は、神経損傷疾患である脊髄損傷に対して、自身の細胞から樹立するiPS細胞と比較して、汎用性や市場性が高いと考えております他家iPS細胞(*17)から分化誘導した神経前駆細胞(*18)を移植することで損傷部位の治療を行う再生医療の研究開発を推進しております。
脊髄損傷は、スポーツでの怪我や交通事故により脊髄に損傷が及ぶケースや、加齢によって、骨が弱くなり転倒して損傷するケースや頸椎の形状が変化し頚髄に負荷がかかり損傷するケースなどがあり、脊髄が損傷した場合、脊髄が脳からの指令や情報を脳幹を通じて体の各部に伝達する役割を果たすことができず、身体の運動機能や感覚機能が完全に停止又は一部停止する、麻痺の症状が発生することがあります。
当社は、まず、慶應義塾大学医学部との共同研究において、損傷による炎症が低下し、かつ、損傷部位が完全に空洞化する前の移植した神経前駆細胞が生着しやすいと考えられる亜急性期の脊髄損傷についての研究開発を優先して進めております。本書提出日現在、慶應義塾大学医学部において「亜急性期脊髄損傷に対するiPS細胞由来神経前駆細胞を用いた再生医療」の医師主導臨床研究が実施されており、当該臨床研究後に、当社において企業治験を行う予定であります。そのための準備として、最適なiPS細胞の選定や分化誘導法の確立、脊髄損傷モデルマウス(*19)の評価、臨床に向けた大量培養方法の検討、各種品質管理項目の検討などを進めており、実用化に向けた取り組みを推進しております。
また、当社では損傷後一定の期間が経過し損傷部位が完全に空洞化して、その空洞化した部分が移植した神経の伸長を阻害する可能性がある慢性期の脊髄損傷についても未だ有効な治療法がないことから研究開発を進めており、将来的には亜急性期の脊髄損傷に関する研究開発と並行して、亜急性期の脊髄損傷と比較して患者数の多い慢性期の脊髄損傷についての企業治験の検討も進めてまいります。さらに、慢性期脳梗塞、慢性期脳出血、慢性期外傷性中枢神経損傷につきましても、外部の研究機関との連携を踏まえて、前臨床の研究を進める予定にしております。
なお、2014年の「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(以下、薬機法)の改正に伴い、再生医療等製品の治験プロセスについては、通常の医薬品の治験プロセスと比較して、早期承認のための制度が追加されており、早期承認の審査の中で、一定数の限られた症例による治験において、安全性の確認と有効性の推定について認められた場合、条件期限付き承認を受けることが可能となり、販売後に更なる安全性と有効性の検証を経て、最終的に承認又は失効するプロセスが導入されました。
当社におきましては、再生医療等製品の各開発パイプラインについて、薬機法に従い、慶應義塾大学医学部等の大学や研究機関と連携して、企業治験のための研究開発を推進してまいります。
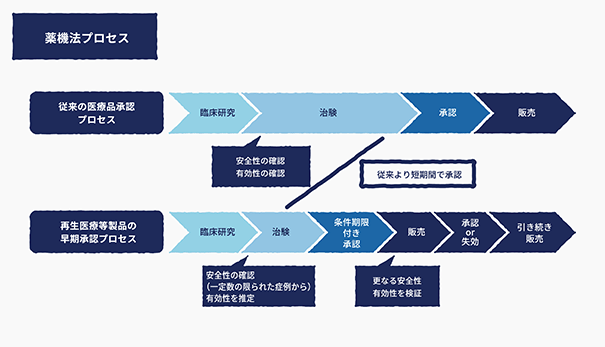
*厚生労働省 薬事法等の一部を改正する法律の概要(平成25年法律第84号)を参考に当社作成
(2)当社のビジネスモデル
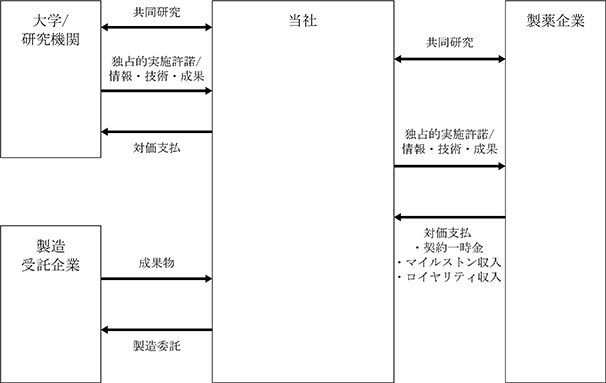
当社の主なビジネスモデルは、慶應義塾大学医学部等の大学機関や医療機関が保有する基礎研究の成果や特許等の知的財産権の独占的な実施許諾権等に基づいた開発パイプライン、又は、当社自らが基礎研究を進めた成果に基づいた開発パイプラインについて、製薬会社等のパートナーと、基礎/探索研究から企業治験の各段階において、共同研究開発や将来の製造販売等の権利の一部又は全部を譲渡するライセンス契約を締結して収入を受領するものであります。
まず、大学機関や医療機関が保有する知的財産権等を活用して共同研究契約を締結する場合は、当社が情報や技術、研究成果等を受け取る一方で、当社から共同研究費用を支払うことになります。
次に、製薬会社等のパートナーと共同研究開発を進める場合においては、当社からは当該パートナー企業に対して、情報や技術、研究成果等を提供する一方で、当社は当該パートナー企業から共同研究開発契約を締結した段階で契約一時金を受領します。共同研究契約締結後は、共同研究開発契約を行った対象の開発パイプラインにおいて設定する個別の各目標の達成状況に応じて共同研究の達成マイルストン収入を受領します。
そして、ライセンス契約においては、当社からは当該パートナー企業に対して、情報や技術、研究成果等を提供する一方で、当社は当該パートナー企業からライセンス契約を締結した段階で契約一時金を受領します。ライセンス契約締結後は、当社はライセンス契約を行った対象の開発パイプラインにおいて設定する個別の各目標の達成状況に応じて共同研究の達成マイルストン収入を受領します。さらに、ライセンス契約の対象の開発パイプラインの上市後は、当社は販売の一部からライセンスのロイヤリティ収入を受領するとともに、販売の達成金額に応じて達成マイルストン収入を受領します。
(当社の一般的な収入形態)
(事業系統図)
(3)当社のパイプライン
本書提出日現在における開発パイプラインの進捗状況は以下のとおりとなっております。
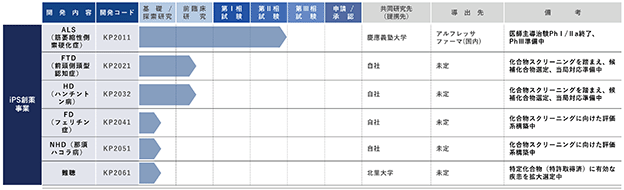
iPS創薬事業における開発パイプラインにおきまして、まず、ALSに関する開発パイプラインであるKP2011について、慶應義塾大学により、iPS創薬の手法でALS患者の細胞から作製したiPS細胞から分化誘導した神経細胞に対して、約1,200の化合物の中から表現型スクリーニングによって見出したパーキンソン病治療の既存薬であるロピニロール塩酸塩をALS患者に投与する医師主導治験(*20)(ALS患者を対象としたロピニロール塩酸塩徐放錠内服投与による第Ⅰ/Ⅱa相試験)を以下の概要で実施いたしました。
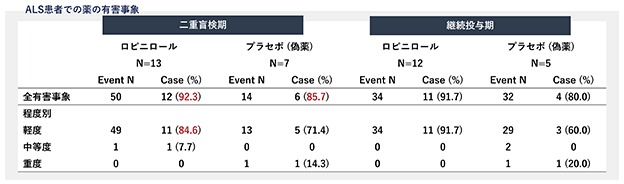
慶應義塾大学による医師主導治験(第Ⅰ/Ⅱa相試験)では、全患者が、最大の量(16mg)を内服することができ、かつ、有害事象のほとんどが軽度なものであり、有害事象による内服の中止がなかったことから、ALS患者に対するロピニロール塩酸塩の安全性と忍容性が確認できました。
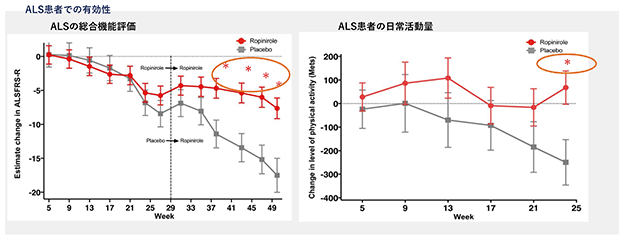
また、有効性についても、ロピニロール塩酸塩の実薬群とプラセボ群との間での投与期間において、実薬群がプラセボ群と比較してALS患者の総合機能評価や日常活動量の低下を抑制して、統計的に一定の有効性があることが示唆されました。
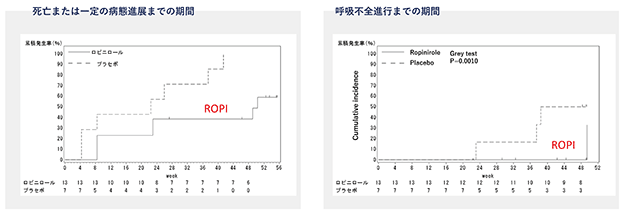
さらに、死亡または一定の病気の進行までの期間を生存期間として検討した結果、生存期間の中央値は,ロピニロール群 50.3週,プラセボ群 22.4週で、計1年の試験期間中に、プラセボ群と比較してロピニロール塩酸塩群において、病気の進行を 27.9 週間(約7ヶ月)遅らせる可能性が示されました。
加えて、ロピニロール塩酸塩群では、最初の6ヶ月の間に、複数の筋肉における筋力低下や活動量の低下が有意に抑制されることがわかりました。
上記の通り、慶應義塾大学において行われましたALS患者を対象としたロピニロール塩酸塩徐放錠内服投与による第Ⅰ/Ⅱa相試験について、ALSに対してロピニロール塩酸塩の一定の安全性、忍容性及び有効性が確認されました。なお、この結果につきましては、論文(「Cell Stem Cell」( Morimoto et al., 2023, Cell Stem Cell 30, 766–780 June 1, 2023 ))により公表されております。
当社におきましては、慶應義塾大学による医師主導治験での成果を踏まえて、2023年3月にアルフレッサ ファーマ株式会社と日本国内における開発権・製造販売権の実施許諾の契約を締結いたしました。本契約により、アルフレッサ ファーマ株式会社が、日本国内におけるロピニロール塩酸塩を活用したALS治療薬の開発・製造販売する権利に基づき、企業治験を進めてまいります。また、当社は本契約の対価として、契約一時金や開発の進捗に応じたマイルストン収入を、また、販売に応じたロイヤリティ収入を受領いたします。
今後におきましては、2020年代後半での上市に向けて、主に導出先であるアルフレッサ ファーマ株式会社が独立行政法人医薬品医療機器総合機構(以下「PMDA」という。)等の各関係機関と協議を進めながら、第Ⅲ相試験(多数の患者様に対する安全性及び有効性の検証を行う試験)の実施に向けた準備を推進してまいります。
また、上記アルフレッサ ファーマ株式会社との提携と並行して、慶應義塾大学との共同研究において、ロピニロール塩酸塩が新規メカニズムに基づいてALS治療効果を示す新規薬剤であることを明確にする研究開発の取組みを行っております。
なお、同パイプラインにつきましては、北米、欧州、インド、中国への海外展開も視野に入れており、製薬会社等のパートナーとのライセンス契約締結に向けた事業開発を推進してまいります。
次に、前頭側頭型認知症の開発パイプラインにおいては、化合物のスクリーニングを完了し、詳細な解析を実施しております。一定の作用メカニズムが確認できた段階で、PMDAに対する事前面談等を行い、その後の開発を実施してまいります。
さらに、ハンチントン病の開発パイプラインにおいてもスクリーニングを実施しており、より高次の評価系を用いて化合物の選定を進めており、同パイプラインにおきましても最終化合物を選定し、一定の作用メカニズムが確認できた段階でPMDA事前相談を行う予定であります。
その他、神経フェリチン症の開発パイプライン、那須・ハコラ病の開発パイプラインについても研究を進めており、引き続き、iPS創薬事業における各研究開発パイプラインの研究開発を推進してまいります。
今後におきましても、iPS創薬の各開発パイプラインについて、研究開発の進捗に応じて、一定の段階でパートナーと共同研究契約またはライセンス契約を締結すべく取り組んでまいります。
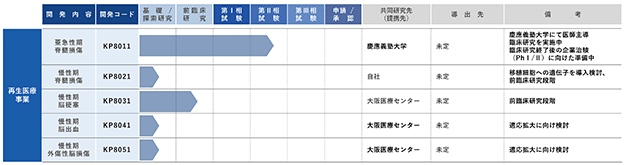
再生医療事業における開発パイプラインにおきましては、亜急性期の脊髄損傷について、慶應義塾大学が「亜急性期脊髄損傷に対する iPS 細胞由来神経前駆細胞を用いた再生医療」の臨床研究を以下の概要で実施しております。
慶應義塾大学では、2021年12月に本臨床研究において世界で初めてiPS細胞から作製した神経前駆細胞を亜急性期の脊髄損傷の患者に移植いたしました(慶應義塾大学 2022年1月 「亜急性期脊髄損傷に対するiPS細胞由来神経前駆細胞を用いた再生医療」の臨床研究について)。
その後、第三者機関である独立データモニタリング委員会(*24)において、2022年3月に、本第1症例目の移植後3か月目までのデータをもとに治療開始後の安全性について評価を行い、第1症例目の患者に対しての移植について安全性に問題はないという当委員会の判定により、本臨床研究における第2症例目以降の移植が継続されております。
当社におきましては、今後の慶應義塾大学主体で実施しております本臨床研究の結果を受けて、同大学と連携して、当社主導による亜急性期の企業治験を円滑に進めるため、最適なiPS細胞の選定や分化誘導法の確立、脊髄損傷モデルマウスの評価、臨床に向けた大量培養方法の検討、臨床用iPS細胞の製品製造における委託先の選定、各種品質管理項目の検討等を推進するとともに、グローバルに再生医療等製品として販売を実施するために、製薬会社等のパートナーとの提携を進めてまいります。
また、慢性期の脊髄損傷及び慢性期脳梗塞等の開発パイプラインについても研究開発の進捗に応じて、企業治験に向けた準備を進めるとともに、一定の段階でパートナーと共同研究契約またはライセンス契約を締結すべく取り組んでまいります。
(用語解説)
4 【関係会社の状況】
該当事項はありません。
5 【従業員の状況】
(1) 提出会社の状況
(注) 1.従業員数は就業人員数であり、休職者を含んでおりません。臨時雇用者数(パートタイマー)は従業員数の100分の10未満であるため、記載しておりません。
2.当社は単一セグメントであるため、事業部門別の従業員数を記載しております。
3.平均年間給与は、基準外賃金を含んでおります。
(2) 労働組合の状況
労働組合は結成されておりませんが、労使関係は円満に推移しております。