第二部【企業情報】
第1【企業の概況】
1【主要な経営指標等の推移】
提出会社の状況
|
回次 |
第4期 |
第5期 |
第6期 |
第7期 |
第8期 |
|
|
決算年月 |
2018年12月 |
2019年12月 |
2020年12月 |
2021年12月 |
2022年12月 |
|
|
事業収益 |
(千円) |
|
|
|
|
|
|
経常利益又は経常損失(△) |
(千円) |
|
|
△ |
△ |
△ |
|
当期純利益又は当期純損失(△) |
(千円) |
|
|
△ |
△ |
△ |
|
持分法を適用した場合の投資利益 |
(千円) |
|
|
|
|
|
|
資本金 |
(千円) |
|
|
|
|
|
|
発行済株式総数 |
(株) |
|
|
|
|
|
|
純資産額 |
(千円) |
|
|
|
|
|
|
総資産額 |
(千円) |
|
|
|
|
|
|
1株当たり純資産額 |
(円) |
|
|
|
|
|
|
1株当たり配当額 |
(円) |
|
|
|
|
|
|
(うち1株当たり中間配当額) |
( |
( |
( |
( |
( |
|
|
1株当たり当期純利益又は 1株当たり当期純損失(△) |
(円) |
|
|
△ |
△ |
△ |
|
潜在株式調整後 1株当たり当期純利益 |
(円) |
|
|
|
|
|
|
自己資本比率 |
(%) |
|
|
|
|
|
|
自己資本利益率 |
(%) |
|
|
|
|
|
|
株価収益率 |
(倍) |
|
|
|
|
|
|
配当性向 |
(%) |
|
|
|
|
|
|
営業活動によるキャッシュ・フロー |
(千円) |
|
|
△ |
△ |
△ |
|
投資活動によるキャッシュ・フロー |
(千円) |
|
|
|
△ |
|
|
財務活動によるキャッシュ・フロー |
(千円) |
|
|
|
|
|
|
現金及び現金同等物の期末残高 |
(千円) |
|
|
|
|
|
|
従業員数 |
(人) |
|
|
|
|
|
|
(外、平均臨時雇用者数) |
( |
( |
( |
( |
( |
|
(注)1.当社は連結財務諸表を作成しておりませんので、連結会計年度に係る主要な経営指標等の推移については記載しておりません。
2.「収益認識に関する会計基準」(企業会計基準第29号 2020年3月31日)等を第8期の期首から適用しており、第8期に係る主要な経営指標等については、当該会計基準等を適用した後の指標等となっております。
3.第6期、第7期及び第8期につきましては、事業収益を計上するものの研究開発活動の拡大により研究開発費が増加し、また経営管理体制の強化により管理費が増加し、事業収益を上回る費用が計上され当期純利益が赤字となっています。
4.第7期及び第8期の財務諸表については、「財務諸表等の用語、様式及び作成方法に関する規則(昭和38年大蔵省令第59号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、有限責任監査法人トーマツの監査を受けております。
なお、第4期及び第5期については、「会社計算規則」(平成18年法務省令第13号)の規定に基づき算出した各数値を記載しております。また、第6期については、「財務諸表等の用語、様式及び作成方法に関する規則(昭和38年大蔵省令第59号)に基づき算出した各数値を記載しております。当該各数値については、金融商品取引法第193条の2第1項の規定に基づく監査を受けておりません。
5.持分法を適用した場合の投資利益については、当社は関連会社を有していないため記載しておりません。
6.第6期の数値については、定時株主総会において承認された数値について、誤謬の訂正による修正再表示を反映しております。
7.1株当たり配当額及び配当性向については、配当を実施していないため記載しておりません。
8.第6期、第7期及び第8期の自己資本利益率については、当期純損失が計上されているため記載しておりません。
9.株価収益率については、当社株式は非上場であるため記載しておりません。
10.第4期及び第5期については、キャッシュ・フロー計算書を作成していないため、キャッシュ・フローに係る各項目については記載しておりません。
11.第6期、第7期及び第8期につきましては、事業収益を計上するものの研究開発活動の拡大により研究開発費が増加し、また経営管理体制の強化により管理費が増加し、事業収益を上回る費用が計上され営業活動によるキャッシュ・フローがマイナスとなっています。
12. 第7期につきましては、研究施設の増床による敷金の差入れの支出により投資活動によるキャッシュ・フローがマイナスとなっています。
13.従業員数は就業人員であり、常用の契約社員を含んでおります。臨時雇用者数(人材会社からの派遣社員を含みます。)は、最近1年間の平均人員を( )外数で記載しております。
14.第6期、第7期及び第8期の潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、当社株式は非上場であるため期中平均株価が把握できず、また、1株当たり当期純損失であるため記載しておりません。第4期及び第5期の潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、当社株式は非上場であるため期中平均株価が把握できないため記載しておりません。
15.当社は、2019年5月17日開催の取締役会決議により、2019年6月30日付で普通株式1株につき10株の割合で株式分割を行っております。第5期の期首に当該株式分割が行われたと仮定し、1株当たり純資産額及び1株当たり当期純利益又は1株当たり当期純損失を算定しております。
16.当社は、2021年10月15日開催の取締役会決議により、2021年11月11日付で普通株式1株につき5株の割合で株式分割を行っております。第7期の期首に当該株式分割が行われたと仮定し、1株当たり純資産額及び1株当たり当期純利益又は1株当たり当期純損失を算定しております。
17.当社は、2019年6月30日付で普通株式1株につき10株の株式分割を行っております。また、2021年11月11日付で普通株式1株につき5株の株式分割を行っております。
そこで、東京証券取引所自主規制法人(現 日本取引所自主規制法人)の引受担当者宛通知「『新規上場申請のための有価証券報告書(Ⅰの部)』の作成上の留意点について」(平成24年8月21日付東証上審第133号)に基づき、第4期の期首に当該株式分割が行われたと仮定して算出した場合の1株当たり指標の推移を参考までに掲げると、以下のとおりとなります。
なお、第4期、第5期及び第6期の数値(1株当たり配当額については全ての数値)については、有限責任監査法人トーマツの監査を受けておりません。
|
回次 |
第4期 |
第5期 |
第6期 |
第7期 |
第8期 |
|
|
決算年月 |
2018年12月 |
2019年12月 |
2020年12月 |
2021年12月 |
2022年12月 |
|
|
1株当たり純資産額 |
(円) |
63.08 |
64.67 |
72.24 |
107.30 |
108.48 |
|
1株当たり当期純利益又は 1株当たり当期純損失(△) |
(円) |
25.70 |
1.60 |
△17.93 |
△20.75 |
△9.87 |
|
潜在株式調整後 1株当たり当期純利益 |
(円) |
- |
- |
- |
- |
- |
|
1株当たり配当額 |
(円) |
- |
- |
- |
- |
- |
|
(うち1株当たり中間配当額) |
(-) |
(-) |
(-) |
(-) |
(-) |
|
2【沿革】
|
2015年4月 |
東京都中央区において国立研究開発法人国立がん研究センター(以下、国立がん研究センター)及び国立大学法人山口大学(以下、山口大学)発のベンチャー企業として設立 |
|
2015年9月 |
山口大学とCAR-T細胞療法に関する共同研究契約を締結 |
|
2015年9月 |
国立がん研究センターとCAR-T細胞療法に関する共同研究契約を締結 |
|
2015年10月 |
山口大学より次世代型CAR-T細胞プラットフォーム技術に関する第三者へのサブライセンス権付き独占実施許諾を取得 |
|
2017年8月 |
武田薬品工業株式会社(以下、武田薬品)(※1)と共同研究開発に関する提携 |
|
2018年12月 |
武田薬品とNIB102及びNIB103導出に関するライセンス契約を締結 |
|
2019年3月 |
東京都港区に本店移転 |
|
2019年8月 |
Adaptimmune Therapeutics plc(※2)と共同開発に関する契約を締結 |
|
2019年11月 |
Autolus Therapeutics plc(※3)とライセンス契約を締結 |
|
2020年7月 |
武田薬品がNIB102の第Ⅰ相臨床試験を開始 |
|
2021年12月 |
武田薬品がNIB103の第I相臨床試験を開始 |
|
2022年1月 |
自社パイプラインNIB101の第I相臨床試験を開始 |
|
2022年8月 |
中外製薬株式会社(以下、中外製薬)とPRIME技術に関するライセンス契約を締結 |
|
※1 武田薬品とは、同社の100%子会社であるMillennium Pharmaceuticals, Inc.を通じ契約しております。 ※2 Adaptimmune Therapeutics plcとは、同社の100%子会社であるAdaptimmune Limitedを通じ契約しております。 ※3 Autolus Therapeutics plcとは、同社の100%子会社であるAutolus Limitedを通じ契約しております。 |
|
3【事業の内容】
当社は、「Create the Future to Overcome Cancer」「がんを克服できる社会の創生に貢献する」という理念の下、独自技術を活用した固形がん(※1)に対するCAR-T細胞療法(※2)の開発を主たる事業領域として事業を展開しております。
固形がんに対する安全かつ有効な治療薬の開発は世界的に求められている課題であり、高いニーズがあります。当社は、山口大学及び同大学の技術移転機関である有限会社山口ティー・エル・オー(以下、山口TLO)から独占的に導入したPRIME技術(※3)を応用したCAR-T細胞という最新のがん免疫療法を介してこの課題を克服することを目指し、事業を展開しております。PRIME技術は、投与するCAR-T細胞のみならず「患者」の体内の免疫細胞を活性化することで優れたがん治療効果を期待することができ、がん免疫応答を利用する多様な細胞医薬品や遺伝子治療を含めた幅広い再生医療の分野に応用できる可能性を有するプラットフォーム技術であります。当社は、プラットフォーム技術であるPRIME技術に固形がんが発現する様々な抗原を標的とした治療技術を組み合わせることにより、固形がんの治療を目的とした様々な遺伝子改変免疫細胞療法を開発しております。
当社は、自社が主導して創生する「自社創薬」に加えて、PRIME技術を他社にライセンスして医薬品開発を進める「共同パイプライン」の2つの事業モデルを有するハイブリッドビジネスモデルを構築しております。これら事業展開により、PRIME技術の市場への展開や周知を加速化して早期の収益確保を図ると同時に、長期的には自社創薬により大型の販売収益を確保することにより、事業全体のリスク分散とサステナブルな成長を目指しております。
なお、当社はがん免疫療法創薬事業のみの単一セグメントであるため、セグメント別の情報は記載を省略しております。
(1)当社の事業領域
日本国内において、がんの死亡数と罹患数は、人口の高齢化を主な要因として男女ともに増加し続けており、2021年のがん死亡数は38万人以上、2019年のがん罹患数は99万人以上と報告されております(出典:国立がん研究センターがん情報サービス「がん統計」(厚生労働省人口動態統計)、国立がん研究センターがん情報サービス「がん統計」(全国がん登録))。日本人が生涯でがんに罹患する確率は、2019年データにおいて、男性で65%、女性で51%とされており(出典:国立がん研究センターがん情報サービス「がん統計」(累積罹患リスク(グラフデータベース)))、また、各がん腫の5年生存率は、特にステージの進んだがんにおいて依然として低く、がんに対する効果的な治療法の開発や普及は極めて重要な社会的課題と言えます。これまで以上に有効性の高い革新的がん治療法の登場は日本のみならず、世界中で強く期待されております。医薬品事業の観点においても、がん領域は極めて大きな市場であり、多くのUnmet medical needs(※4)が存在します。
従来、がんに対する治療法は外科療法、化学療法(抗がん剤)、放射線療法が主な方法でしたが、近年、免疫の力を利用してがんを攻撃する「がん免疫療法」が確立されてきました。本来、免疫システムはウイルスや細菌など、自分自身以外の異物を認識し、排除する働きを有しており、がん細胞を認識し排除する能力もあることが知られております。この能力を回復させたり、増強させたりすることでがんの治療を目指す創薬技術が「がん免疫療法」です。特に、2018年のノーベル生理学・医学賞の受賞により注目を浴びた免疫チェックポイント阻害薬(※5)の開発により、がん免疫療法は大きな発展を遂げております。従来のがん治療法では延命や根治することが難しかった進行がんに対しても免疫チェックポイント阻害薬がある程度の治療効果を発揮することがわかっており、その適応範囲は世界中で拡大しております。2021年の世界の医薬品市場において、がん領域治療薬の売上高トップ2はともに免疫チェックポイント阻害薬であり、その合計売上高は288億ドルと報告されております(出典:IQVIA 世界の医薬品市場データ)。
しかしながら、免疫チェックポイント阻害薬にはまだ多くの課題があります。免疫チェックポイント阻害薬は全てのがんに対して治療効果を発揮できるわけではなく、また治療効果が得られたとしても単剤での有効性は10-30%程度と言われております(出典:Clin Cancer Res. 2020 Sep 15;26 (18): 4842-4851)。免疫チェックポイント阻害薬の効果がみられない「患者」では、がん細胞を攻撃する免疫細胞の能力が十分に回復・増強されていない状況であり、さらに強力で、かつ、免疫チェックポイント阻害薬とは異なる働きでがんを攻撃できるような新たな免疫療法が必要とされており、「CAR-T細胞療法」等にかかる研究開発が拡大しております。
(CAR-T細胞療法について)
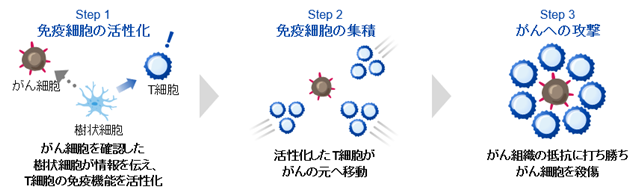
免疫チェックポイント阻害薬は「免疫のブレーキを解除する」ことで免疫細胞、特にT細胞(※6)の能力を高めてがん細胞を攻撃する治療法ですが、それとは異なるアプローチとして、遺伝子改変技術(※7)を用いて「T細胞の能力を直接的に増強する」ことでがん細胞を攻撃する方法が「遺伝子改変T細胞療法」です。特に、体外に取り出したT細胞に、がん細胞表面のがん抗原(※8)を認識するCAR(Chimeric Antigen Receptor:キメラ抗原受容体)遺伝子を導入することでCAR-T細胞を作製し、当該CAR-T細胞を大量に増やしてから「患者」に投与する「CAR-T細胞療法」が高い注目を集めております(図1)。CARは、がん細胞を認識する抗体由来の部分と、T細胞の強い活性化を誘導するシグナル伝達部分、及びこの両者をつなぐ部分からなる人工的受容体(※9)で、CAR-T細胞は、がん細胞を見つけると強く活性化し、がん細胞を攻撃する一方で、がん抗原を持っていない正常細胞は攻撃しない、という特徴を有しております。
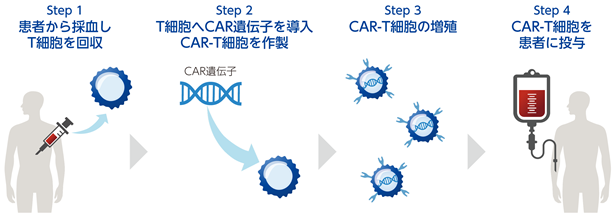
|
図1. CAR-T細胞療法のしくみ 体外に取り出したT細胞にCAR遺伝子を導入したうえで培養し、大量のCAR-T細胞を作製して投与します。CAR遺伝子はがんを認識する細胞外の抗体部分とT細胞のがん攻撃能力を高めるための細胞内シグナル部分から構成されます。 |
(通常型CAR-T細胞療法の課題)
CAR-T細胞療法は、血液がん(※10)に対して非常に高い有効性が実証されており、日本を含めた複数の国で既に医薬品として承認され、従来の治療法では効果のない「患者」に対して高い治療効果を示しております。しかしながら、血液がん以外の固形がんに対しては未だ有効性は示せておらず、さらに技術改良を進めた次世代型CAR-T細胞の技術開発及び臨床応用が急務とされております。CAR-T細胞が血液がんに対して有効である一方、固形がんには効果を発揮しにくい原因として、塊を作らずに血管内やリンパ管内で増えていく血液がんではCAR-T細胞が一対一でがん細胞を攻撃できるのに対し、固形がんは塊として臓器の中でがん細胞が増えていくため、がん組織の内部にまでCAR-T細胞が到達することが難しい、ということが考えられます(図2)。また、血液がんはCAR-T細胞の標的となるがん抗原を均一に持っておりますが、固形がんではがん抗原が不均一にしか出ておらず、CAR-T細胞のみで全てのがん細胞を攻撃するのが難しい、という原因が知られております。固形がんは全てのがんの約9割を占めており(出典:WHO Cancer Tomorrow)、固形がんに対して有効性を発揮しうる技術を有する次世代型CAR-T細胞療法が開発されれば、がん治療薬市場に大きな影響を与えるものと考えられます。なお、近時、CAR-T細胞療法が固形がんに対して一定の有効性及び安全性を示す研究結果も示されており(Claudin 18.2標的CAR-T細胞に関する第I相臨床試験の中間結果。Nature Medicine volume 28, pages1189–1198 (2022) )、固形がんの治療に対するCAR-T細胞療法の可能性を示していると考えております。
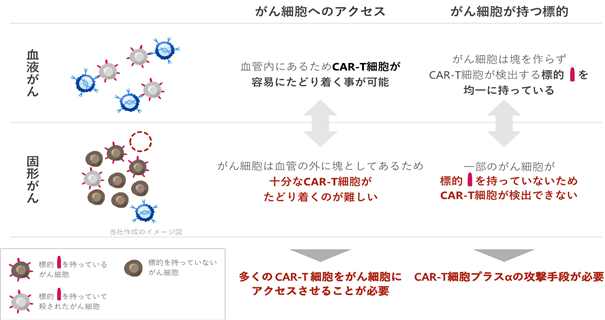
|
図2. CAR-T細胞療法によるがん治療効果 現在使われている通常のCAR-T細胞療法は、血液がんに対しては優れた有効性を発揮する一方、がんの約9割を占める固形がんに対しては有効性が弱く、新たな技術開発が求められております。 |
(2)PRIME CAR-T細胞療法
当社は、固形がんに対して効果を発揮する次世代型CAR-T細胞を創薬するために、当社代表取締役であり山口大学教授の玉田らが開発した「PRIME技術」を応用しております。PRIME技術とは、免疫細胞の活性化や集積を誘導するサイトカイン(※11)やケモカイン(※12)を産生するようにCAR-T細胞などの免疫細胞に更なる遺伝子改変を加えた技術であり、当社はPRIME技術を搭載したCAR-T細胞療法を「PRIME CAR-T細胞療法」と称しております。当社では、インターロイキン7(IL-7: interleukin-7)というサイトカインとchemokine (C-C motif) ligand 19(CCL19)というケモカインを同時に産生するPRIME CAR-T細胞を複数開発しており、これまでの様々な動物実験において、固形がんに対して従来のCAR-T細胞と比べて高い効果を発揮することが示されております。これらのデータは玉田らのグループによりNature Biotechnology誌で発表されました。
PRIME CAR-T細胞では固形がんの局所でCAR-T細胞自身がIL-7とCCL19を産生するように遺伝子改変しております(図3)。CCL19はT細胞や抗原提示細胞(※13)である樹状細胞(※14)のがん局所への集積やがん組織内への浸潤を促進する働きがあります。また、IL-7は集積したCAR-T細胞やT細胞の活性化や増殖を誘導すると同時に、その寿命を長くすることが知られております。この際、PRIME CAR-T細胞から産生されるIL-7とCCL19は他のPRIME CAR-T細胞のみならず、体内のT細胞や樹状細胞も固形がんの組織内に浸潤させる機能を有しております。
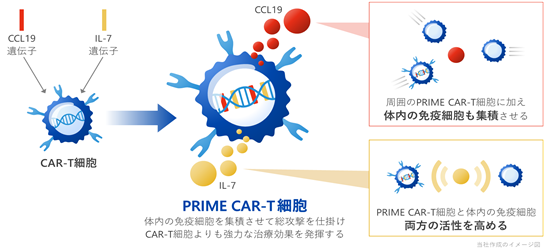
|
図3. PRIME CAR-T細胞療法によるがん治療 PRIME CAR-T細胞では通常のCAR遺伝子に加えて、IL-7とCCL19が搭載されており、免疫細胞を固形がんの内部に呼び寄せ、さらに増殖させて寿命を延ばすことで固形がんに対して治療効果を誘導します。 |
集積した樹状細胞は、PRIME CAR-T細胞によって破壊されたがん細胞から様々ながん抗原を取り込み、体内のT細胞にがん抗原を提示してT細胞の活性化を誘導します。このような現象をエピトープスプレッディング(エピトープ拡大)(※15)と呼び、一種類ではなく様々ながん抗原を出す固形がんに対して免疫療法の効果を誘導するために極めて重要なステップと考えられております。また、IL-7はメモリーT細胞(※16)の生存を維持する働きがあることから、PRIME CAR-T細胞療法では通常のCAR-T細胞療法と比べて長期間、治療効果が持続することが期待されます。このように、当社の技術は免疫細胞の集積や浸潤を増強し、増殖を誘導することからPRIME(Proliferation-inducing and migration-enhancing)技術と称しております(図4)。
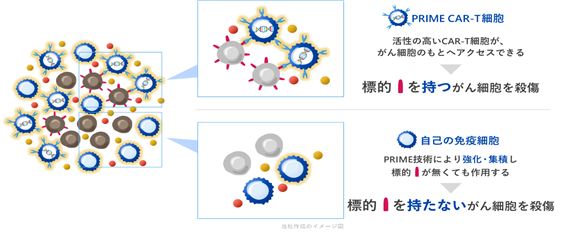
|
図4. PRIME CAR-T細胞による固形がんへのアプローチ PRIME CAR-T細胞ががん細胞を攻撃することにより、CARの標的とは異なる様々ながん抗原が放出され、CCL19とIL-7に反応して固形がんの内部に呼び寄せられて増殖した免疫細胞は、これらの様々ながん抗原を認識してがん細胞を攻撃することで、CAR-Tの標的を持たない固形がんに対しても治療効果を発揮できます。 |
(3)PRIME CAR-T細胞療法の非臨床研究データ
玉田らのグループが発表した研究では、PRIME CAR-T細胞を刺激するとPRIME CAR-T細胞からCCL19の分泌が促進され、ナイーブT細胞(※17)や樹状細胞(※18)の遊走(※19)が増加することを、培養容器の空間を2つに仕切り細胞が移動できるトランスウェル®(※20)という研究手法を用いて確認しました。ナイーブT細胞や樹状細胞と、通常のCAR-T細胞やPRIME CAR-T細胞を分離し、通常のCAR-T細胞やPRIME CAR-T細胞を抗CD3抗体(※21)やPRIME CAR-T細胞の標的抗原で刺激したところ、PRIME CAR-T細胞の場合には、通常のCAR-T細胞と比べて、遊走してくるナイーブT細胞や樹状細胞の数が多いことが示されました(図5)。
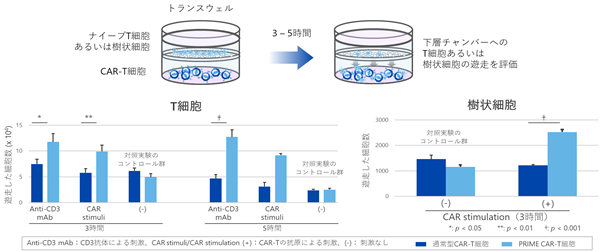
|
図5. CCL19の効果を確認する細胞遊走試験 CCL19を産生するPRIME CAR-T細胞は、ナイーブT細胞や樹状細胞の集積機能が通常のCAR-T細胞よりも増強していることが確認できました。P値は統計学的な有意性を示し、P値が低いほど有意性が高く、0.05未満を有意差ありとしています。 |
また、IL-7を産生するPRIME CAR-T細胞は、通常のCAR-T細胞と比較して、細胞分裂回数、生細胞数、生存率が高い傾向にあることが示されました。細胞の分裂をモニターするために用いられる色素であるCyoTell™ BlueでPRIME CAR-T細胞もしくは通常のCAR-T細胞を染色し、標的抗原にて刺激したところ、1週間の経過で、PRIME CAR-T細胞は通常のCAR-T細胞と比較して、細胞分裂が多いだけでなく、生存率が高いことがわかりました。(図6)。
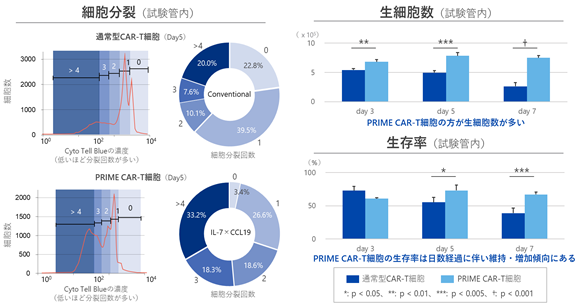
|
図6. IL-7の効果を確認する細胞分裂試験及び生細胞数の確認試験 IL-7を産生するPRIME CAR-T細胞は細胞分裂や生細胞数、生存率が通常のCAR-T細胞よりも増強していることが確認できました。 |
現在当社が開発しているPRIME CAR-T細胞パイプラインは、サイトカインとケモカインの組み合わせとしてIL-7とCCL19を利用しております。この組み合わせは決して無作為に選択されたものではありません。ヒトの正常なリンパ組織(※22)には多くのT細胞が集積したT細胞領域と呼ばれる部分があり、その部分の形成にはIL-7とCCL19が重要な働きをしていることが知られております。当社の開発しているPRIME技術は生体内で認められるIL-7とCCL19の生理学的機能を応用して固形がんの組織内にT細胞を集積させる、言い換えれば、生物の進化の過程でT細胞領域形成のために選択されたIL-7とCCL19という生理的な組み合わせを、遺伝子改変という科学技術を用いてCAR-T細胞に搭載し、がん治療のために応用したユニークな技術です。これは、単にCAR-T細胞の活性化や増殖を誘導するためのサイトカインを搭載した他のCAR-T細胞技術とは大きくコンセプトが異なります。
マウス実験モデルにおいて、CARターゲットのCD20(※23)を発現している肥満細胞腫(※24)であるP815-CD20(※25)を皮下接種して固形がんを形成させた後、無治療群、通常のCAR-T細胞療法群、IL-7のみを産生する細胞を用いたCAR-T細胞療法群、CCL19のみを産生する細胞を用いたCAR-T細胞療法群、PRIME CAR-T細胞療法群の5つの治療群にて、マウスの生存を観察しました。その結果、最初の4つの処理群ではマウスの長期生存は観察されなかった一方で、PRIME CAR-T細胞処理群における全てのマウスが観察期間の最後まで生存することが確認されました(図7)。
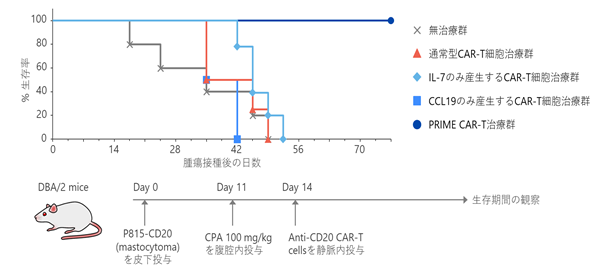
|
図7. マウス実験モデルでのPRIME CAR-T細胞の固形がん治療効果 IL-7とCCL19の両方を産生するPRIME CAR-T細胞は通常のCAR-T細胞に比べて優れたがん治療効果を発揮する一方、IL-7のみ、又はCCL19のみを産生するCAR-T細胞ではがん治療効果の増強は認められませんでした。 |
さらに、PRIME CAR-T細胞療法がどのようなメカニズムで固形がんに対する優れた治療効果を発揮しているのかを調べるために、マウスに投与したCAR-T細胞の体内動態を観察できるシステムを利用して検討したところ、PRIME CAR-T細胞は固形がんの部分に効率的に集まっていることがわかりました。通常のCAR-T細胞ではこのような現象は認められませんでした。また、PRIME CAR-T細胞はがんの部分にのみ集まっており、それ以外の正常の臓器には集まっていないことも判明し、PRIME CAR-T細胞療法の安全性を示唆するデータも得られております。PRIME CAR-T細胞で治療したマウスのがん組織を顕微鏡レベルで調べてみたところ、非常に多くの免疫細胞が集まっていることが証明されました。さらに、集まっている細胞はPRIME CAR-T細胞のみならず、マウスの体内にもともとあった免疫細胞も含まれていることがわかりました。このような現象は通常のCAR-T細胞療法では認められませんでした(図8)。

|
図8. PRIME CAR-T細胞の固形がんへの集積 PRIME CAR-T細胞は固形がんの部分にのみ選択的に集まっていました。がん組織内部においては、PRIME CAR-T細胞のみならず、もともと体内にあったT細胞も集まっていました。(CD20をターゲットにしたモデルによるデータ) |
PRIME CAR-T細胞の優れた治療効果は、ヒトT細胞から誘導したPRIME CAR-T細胞を用いた実験でも示されております。ヒトの肺がん細胞株を皮下接種した免疫不全マウス(※26)にヒトT細胞から作製したPRIME CAR-T細胞を投与したところ、がん細胞の増殖は顕著に抑えられることが判明しました(図9)。このような効果はCARを遺伝子導入していないヒトT細胞や通常のCARを遺伝子導入したヒトT細胞では認められませんでした。このように、IL-7とCCL19の組み合わせにより固形がんに対して強力な治療効果を発揮するPRIME CAR-T技術はヒトT細胞の場合でも優れた治療効果が認められました。
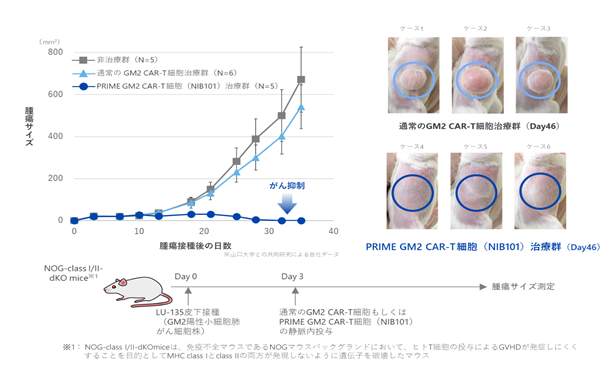
|
図9. ヒトT細胞から作製したPRIME CAR-T細胞によるがん治療効果 ヒト肺がん細胞を接種した免疫不全マウスに、ヒトT細胞から作製したPRIME CAR-T細胞を投与したところ、腫瘍増殖が顕著に抑制されることが判明しました。腫瘍接種後46日目のマウスの写真(右)において、PRIME CAR-T細胞治療では腫瘍が消失していることが認められます。(GM2をターゲットにしたモデルによるデータ) |
(4)PRIME CAR-T細胞療法の臨床試験データ
武田薬品は、第37回米国がん免疫学会総会(Society for Immunotherapy of Cancers : SITC) において、NIB102 (TAK-102)の第Ⅰ相臨床試験に関する中間結果を発表しました。標準治療に不耐又は不応のグリピカン3(GPC3)発現固形がん患者を対象とした第Ⅰ相臨床試験の予備的データでは、NIB102 (TAK-102)を投与された4名の患者において、用量制限毒性(※27)やサイトカイン放出症候群(※28)、神経毒性(※29)などの有害事象は1例も認められませんでした。また、投与患者のうち2例はSD(Stable Disease)(※30)を達成しました。NIB102 (TAK-102)は、低用量レベルにおいて、好ましい細胞動態を示しており、細胞増加と持続性において用量依存的な増大を示しました(図10)。SDを呈した患者とPD(Progressive Disease)(※31)を呈した患者を比較した場合、AFP(Alpha Fetoprotein)(※32)やLDH(Lactate Dehydrogenase)(※33)といった関連する疾患バイオマーカー(※34)において、NIB102 (TAK-102)の末梢細胞動態や腫瘍微小環境プロファイルと相関性のある好ましい変動が認められました。
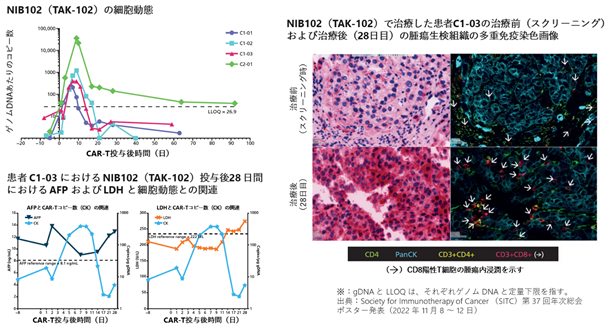
|
図10. NIB102 (TAK-102)の第Ⅰ相臨床試験に関する中間結果 NIB102 (TAK-102)の細胞動態及びその腫瘍マーカーとの関連性、がん組織内における免疫応答の誘導について解析が行われました。NIB102 (TAK-102)の投与に伴い、血中のCAR-Tコピー数の増加が認められました(左上図)。また、患者C1-03においては、CAR-T細胞の増加に伴い、がんの疾患マーカーであるAFP及びLDHの一時的な低下を認め(左下図)、治療後に生検した腫瘍組織において免疫細胞の浸潤が増加している部分が認められました(右図)。 |
(5)PRIME技術の拡張性と応用性
PRIME技術の根幹は、免疫細胞の集積や浸潤、増殖などを誘導するサイトカインやケモカインをCAR-T細胞に産生させることで、CAR-T細胞自体のがん攻撃能力を高めるのみならず、「患者」自身の免疫細胞を活性化し、固形がんに対する多様な攻撃を介して長期の治療効果を誘導することです。従って、PRIME技術の適応はCARの認識する標的分子(※35)の種類に依存しません。つまり、標的分子の数に応じてPRIME技術が拡張する可能性がある、ということです。
(PRIME技術と免疫チェックポイント阻害薬との併用効果)
当社は、免疫チェックポイント阻害薬とPRIME CAR-T細胞の併用についても検討しています。山口大学との共同研究で行ったマウス実験では、マウスにがん細胞を皮下接種して固形がんを形成させた後、PRIME CAR-T細胞とPD-1シグナル(※36)を遮断するPD-1抗体(※37)の両方を投与したところ、PRIME CAR-TとPD-1抗体との組み合せにおいて、それぞれの単独や、通常型CAR-TとPD-1抗体との組み合せに比較して、より強力な腫瘍治療効果が認められました(図11)。
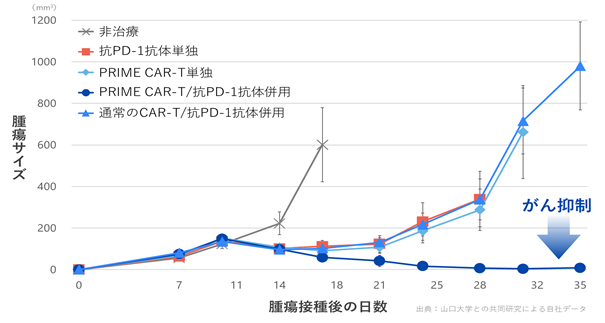
|
図11. PRIME CAR-T細胞と免疫チェックポイント阻害薬との併用効果 CAR-T細胞の投与量を少なくし、PRIME CAR-T単独では治療効果が出にくい条件におけるマウスモデルにおいて、PRIME CAR-T細胞とPD-1抗体との組み合せは固形がんに対して優れた治療効果が認められました。 |
(PRIME技術のTCR-T細胞療法への応用)
PRIME技術の適応はCAR-T細胞療法に限定されず、同様の遺伝子改変T細胞療法であるTCR-T細胞療法(※38)にも応用が可能であり、当社においては、既に「共同パイプライン」における契約実績もあります。
山口大学との共同研究で得られたデータでは、PRIME TCR-T細胞が、通常のTCR-T細胞と比較して優れた治療効果を示し、マウスを用いた動物モデルで通常のTCR-T細胞よりも腫瘍の増殖を抑制することが認められました(図12)。
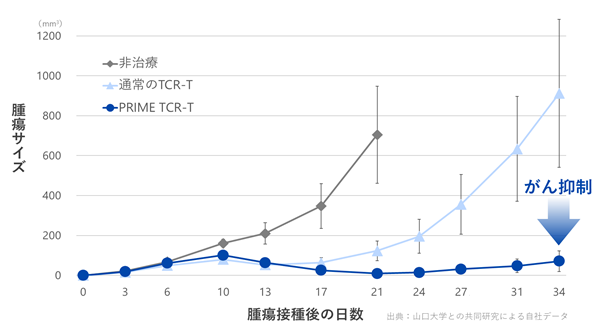
|
図12. PRIME TCR-T細胞によるがん治療効果 腫瘍細胞を皮下接種したマウスモデルにおいて、PRIME TCR-T細胞の投与は通常のTCR-T細胞の投与よりも強力な治療効果が認められました。 |
(PRIME技術の腫瘍溶解性ウイルスへの応用)
さらに、当社のPRIME技術は上述の細胞療法のみならず、腫瘍溶解性ウイルス(※39)などの遺伝子治療を増強するためにも有用であることが期待されます。サイトカインとケモカインの組み合わせを産生する腫瘍溶解性ウイルスが腫瘍を溶解してエピトープスプレッディングを引き起こし、「患者」自身のT細胞や樹状細胞が集積してPRIME技術特有の効果を発揮することが期待されます。
(PRIME技術の高い拡張性)
PRIME技術は、NK細胞(※ 40)やγδ型T細胞(※41)を利用したがん免疫細胞療法、TIL療法(※42)、iPS細胞(※43)を利用したがん免疫療法などにも応用可能と考えております。また、現時点における当社の開発パイプラインはいずれも「患者」自身の免疫細胞から製造する自家(※44)のPRIME CAR-T細胞ですが、健常人の免疫細胞から製造する他家(※45)のCAR-T細胞についてもPRIME技術の応用が可能と考えています。当社は、2020年5月に、ゲノム編集技術(※46)の1つであるCRISPR-CAS3(※47)技術を有するC4U株式会社と、また、2023年2月に、多能性幹細胞から免疫細胞を作製する技術を有するリバーセル株式会社と、共同研究及び事業化に関する提携を行い、それぞれの技術を用いた他家技術の研究開発も進めております。他家によるCAR-T細胞療法が可能となれば、健常な細胞提供者から採取したT細胞を用いて大量に製造したCAR-T製品を保管しておくことで、量産化によるコスト削減効果も期待されます。さらに、当社のPRIME技術はがん「患者」自身の免疫機能を高める効果があるため、通常の他家CAR-T細胞よりも優れた効果を期待することができます。以上のように、PRIME技術はがん免疫応答を利用する多様な細胞医薬品や遺伝子治療を含めた幅広い再生医療の分野に応用できる可能性を有しており、当社はPRIME技術の高い拡張性を活かした事業展開を目指しております(図13)。
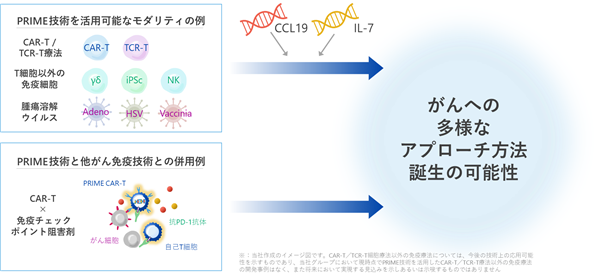
|
図13. PRIME技術の拡張性 PRIME技術は様々ながん免疫細胞療法やウイルス療法、抗PD-1抗体との併用など、様々なモダリティに展開することが可能なプラットフォーム技術であり、他社技術との協働により更に多くのアプローチの開発が可能です。 |
また当社は、PRIME CAR-T細胞療法を多くのがん「患者」に提供するために、澁谷工業株式会社(以下、澁谷工業)と遺伝子改変免疫細胞の自動製造システムに関する共同開発を進めております。当社が培ってきたCAR-T細胞培養のノウハウを応用し、高品質のCAR-T細胞を無菌状態にて効率的に自動培養できるシステムを開発しております。これにより、複雑なCAR-T細胞の製造過程における人的ミスを回避し、大量のCAR-T細胞を連続製造することが可能となり、コストの削減や品質の安定化、迅速な治療薬提供に貢献できると考えております(図14)。
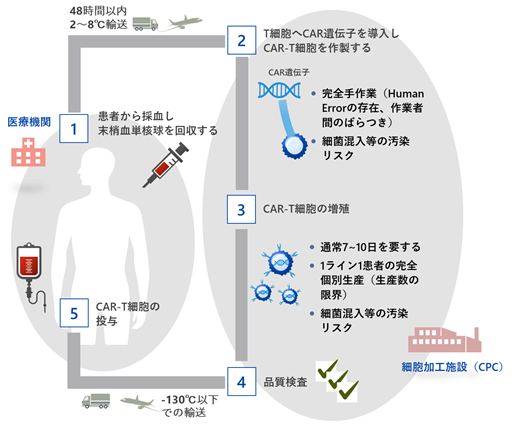
|
図14. PRIME技術の拡張性 PRIME技術は様々ながん免疫細胞療法やウイルス療法、抗PD-1抗体との併用など、様々なモダリティに展開することが可能なプラットフォーム技術であり、他社技術との協働により更に多くのアプローチの開発が可能です。 |
(6)当社のビジネスモデルについて
当社は、自社研究や大学や研究機関との共同研究、また国内外の企業との共同研究開発を通じて、がん免疫療法に関する技術及びパイプラインの開発を進めております。当該研究開発の結果として生まれた知的財産権は、自社又は共同研究を実施した研究機関との共同で特許を出願しております。それらの知的財産権は、当社の研究開発過程にて医薬品として事業化の可能性を高めた後、国内外の製薬企業に対して特定の標的分子に限定して医薬品の開発、製造、販売の権利等をライセンスします。当社は技術アクセス料、契約一時金、開発の進捗に応じたマイルストン収入、販売額に応じたロイヤリティ、販売経過年数や販売目標の達成に応じたマイルストン収入等を得ることができます。また、このほか、共同研究において研究開発費の負担金の支払いを受けることもあります。
[事業系統図]
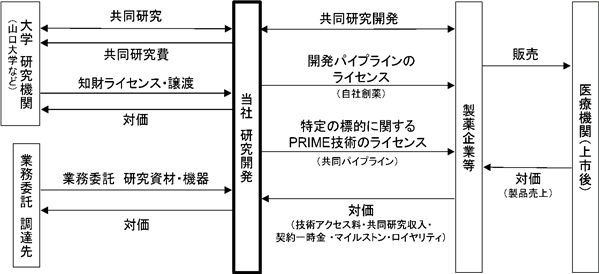
①ハイブリッド型ビジネスについて
当社は、CAR-T細胞療法等を主軸にがんの治療法創出の研究・開発を行うがん免疫療法創薬事業の単一セグメントでありますが、開発主導の違いから、「自社創薬」及び「共同パイプライン」の2つの事業モデルを有しております。「自社創薬」においては、当社は、自社が主導して開発を進行しており、また、「共同パイプライン」においては、PRIME技術を他社にライセンスして医薬品開発を進めております。
これら事業展開により、共同パイプラインを通じてPRIME技術の市場への展開や周知を加速化して早期の収益確保を図ると同時に、長期的には自社創薬により大型の販売収益を確保することにより、事業経営におけるリスク分散及びサステナブルな事業成長を目指しており、これにより、がん治療市場における競合他社との差別化を図ることができると考えております。
|
|
自社創薬 |
共同パイプライン |
|
基礎技術基盤 |
当社独自のPRIME技術 |
|
|
創薬標的※ |
自社が選定した標的抗原に対してPRIME技術を利用した医薬品開発を行う |
契約先が選定した標的抗原に対してPRIME技術を利用した医薬品開発を行う |
|
開発主導・開発コスト |
自社(ライセンス後は契約先) |
契約先 |
|
収入形態 |
(ライセンス後) ・技術アクセス料 ・共同研究収入 ・契約一時金 ・開発マイルストン収入 ・販売開始年経過マイルストン収入 ・販売目標達成マイルストン収入 ・ロイヤリティ |
・技術アクセス料 ・共同研究収入 ・契約一時金 ・開発マイルストン収入 ・販売開始年経過マイルストン収入 ・販売目標達成マイルストン収入 ・ロイヤリティ |
|
事業の特徴 |
先行投資が多額になり、投資回収期間が長期になるが、収益規模は大型となりやすい |
先行投資は極めて少なく、早期の収益確保が可能だが、収益規模は中程度 |
|
契約先事例 |
Millennium Pharmaceuticals, Inc.(武田薬品) |
・Adaptimmune Therapeutics plc ・Autolus Therapeutics plc ・中外製薬 |
※創薬標的については、「自社創薬」と「共同パイプライン」で重複しないよう、当社で管理し、調整しています。
(a) 「自社創薬」
「自社創薬」は、一般的な創薬事業と同様に当社が標的抗原の選定から開発まで手掛ける事業モデルであり、当社が選定した標的抗原に対してPRIME技術を利用したCAR-T等のパイプラインを創製し、当社が研究開発を主導して実施する事業モデルであります。
開発パイプラインについて、自社にて薬事承認取得を目指して開発を進め、承認段階又はその中途段階において製薬企業等にライセンスアウトすることにより収益獲得を図っております。当社における研究開発費や人員等の開発コストが大きく、また、複数のパイプラインを同時に展開することが困難でありますが、研究開発の進捗及び開発確度が高まった段階でのライセンスアウトが可能となり、パイプライン当たりの契約総額は比較的大規模となる傾向があります。当社は、自社にて臨床試験を実施し製造販売以降は製薬企業へのライセンスを行うことを基本方針としておりますが(下図自社創薬-モデルC)、ライセンス先となる製薬企業等のニーズや、研究開発状況、想定される開発コスト又は収益規模等の状況に応じてライセンスのタイミングを変更する又は将来的には医薬品の製造販売までを自社にて行う等の選択を戦略的に行う可能性もあります。
(b) 「共同パイプライン」
「共同パイプライン」は、PRIME技術を既に標的抗原を有する製薬企業等に対しライセンスする事業モデルであり、契約先が選定し当社と合意した標的抗原に対し、当社のPRIME技術を応用したCAR-T等の遺伝子改変免疫細胞等のパイプラインの研究開発を実施します。早期段階でのPRIME技術のみのライセンスアウトが主体のため、一件当たりの契約総額は自社創薬に比較すると小規模となりますが、当社の開発投資や自社リソース投下は限定的であり、製薬企業のニーズに応じてパイプライン数が積み上がりやすい傾向があります。これにより、ポートフォリオ拡大による競争上の優位性を得ることができ、また、標的抗原の増加によりPRIME技術の対象となり得る患者を拡大することも期待できます。
共同パイプラインに関する契約は、標的の選定やPRIME技術を組み合わせるためのCAR-Tなどの創製から開始する場合(下図共同パイプライン-モデルA)や、既にライセンス先が有するパイプラインにPRIME技術を上乗せする場合(下図共同パイプライン-モデルB)があります。なお、自社創薬と共同パイプライン共通して、契約先の希望に応じて、特定の標的抗原決定に先立って技術評価を実施する場合があります(下図共同パイプライン-モデルC:(例:第一三共株式会社))。なお、既に契約を締結している企業以外に、今後の継続的なアライアンス獲得に向け、常時候補企業との協議を実施しております。
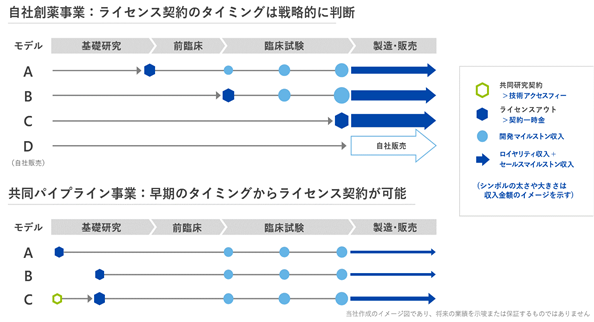
②収入形態について
当社事業展開においては、「自社創薬」及び「共同パイプライン」ともに、契約締結又はライセンスアウト時における「契約一時金」、研究開発進展等の予め契約にて定めたマイルストンの達成時に得られる収入である「マイルストン収入」、医薬品上市後の販売に応じて一定率を受領する「ロイヤリティ」等の収益獲得を基本としておりますが、これら経済条件については個別パイプライン毎にライセンス企業と協議の上で決定されます。
一般的な収入形態の概要は以下のとおりでありますが、各収入について当社が締結する全ての契約に設定されるとは限りません。また、各収入については、会計上の収益認識タイミングとは必ずしも一致するものではありません。
技術アクセス料:
PRIME技術の利用及び指導等に対し、契約先から得られる収入で、自社パイプラインや共同パイプラインにおけるPRIME技術に対する技術評価契約や共同研究契約を締結する際に設定します。
共同研究収入:
共同研究契約やライセンス契約において、PRIME技術を用いた共同研究を実施する際に契約先から得られる収入で、当社の研究実費に基づき設定します。
契約一時金:
共同研究契約やライセンス契約の契約時に設定し得られる収入で、アップフロント収入と表現することもあります。基本的に自社創薬と共同パイプラインいずれのライセンス契約でも設定します。
開発マイルストン収入:
ライセンス契約において、臨床試験の開始時や承認時など、契約で定めた開発の進捗に応じて得られる収入で、基本的に自社創薬と共同パイプラインいずれのライセンス契約でも設定します。
販売開始年経過マイルストン収入:
ライセンス契約にかかる製品が上市された後に、設定した販売期間に達するごとに受領する収入で、自社創薬と共同パイプラインいずれのライセンス契約でも設定する場合があります。
販売目標達成マイルストン収入:
ライセンス契約にかかる製品が上市された後に、設定した売上目標に達するごとに受領する収入で、自社創薬と共同パイプラインいずれのライセンス契約でも設定する場合があります。
ロイヤリティ:
ライセンス契約にかかる製品が上市された後に、その売上に応じて設定した一定割合を受領する収入で、基本的に自社創薬と共同パイプラインいずれのライセンス契約でも設定します。
(7)パイプラインについて
当社の開発パイプラインや他社との共同プロジェクトとその進捗状況は以下のとおりです。2023年5月現在、標的抗原又は技術の異なる複数のプロジェクトを進めております。
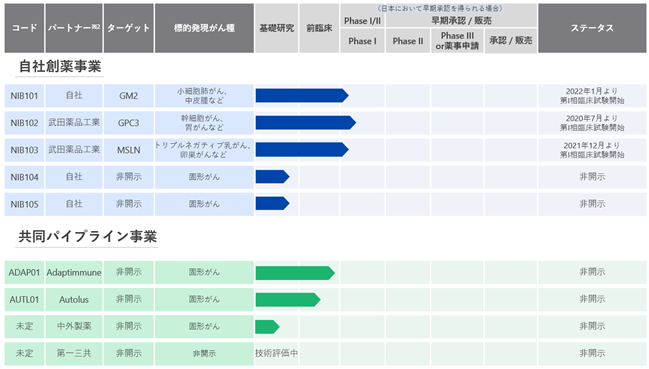
※開発、販売地域はアライアンス先の開発・販売戦略毎に異なります。上記の情報には、現在入手可能な情報に基づく当社の判断による、将来に関する記述が含まれています。そのため、上記の情報は様々なリスクや不確実性に左右され、実際の開発状況はこれらの見通しとは大きく異なる可能性があります。
|
NIB101 |
概要 |
固形がんの標的抗原であるGM2に対するPRIME技術を活用した自家CAR-T細胞療法パイプラインです。協和キリン株式会社の協力により、同社で開発された抗GM2抗体由来の配列を利用し、CAR-Tが創製されました。 |
|||||||||||||||
|
提携状況 |
NIB101については、非臨床試験から臨床試験の段階まで自社で開発を進め、その後適切な段階※で製薬企業にライセンスする方針です。現時点において、商業化に係る権利は全て当社が保有しております。 ※治験でのデータ取得状況や提携相手との交渉状況によって決まるため具体的なタイミングは未定でありますが、現時点での当社の方針としては、臨床試験における有効性の確認を一つの契機としてライセンスすることを想定しております。 |
||||||||||||||||
|
開発状況 |
現在、第I相臨床試験を実施中です。治験実施者により公表されている治験の概要は以下の通りです。
|
||||||||||||||||
|
今後のステップ |
第I相臨床試験で安全性が認められ有効性が推定される場合には、早期承認制度を通じてより早い実用化を目指しますが、現在行っている第I相臨床試験において早期承認が得られない場合は追加試験を行うことや、治験プロトコールの変更等により更なる有効性の確認を行う等のステップに移行する予定であります。 |
||||||||||||||||
|
対象となり得る患者について |
本試験においては、標準治療に不応・不適もしくは不耐であり、GM2の発現が確認された固形がん患者(小細胞肺がん、悪性胸膜中皮腫などを含む)がNIB101の対象となり得ると考えます。ただし、これらの患者全てにPRIME CAR-Tが使用できる訳ではなく、病状や治療期間の問題等から治療を選択しない場合や、設備の問題等により治療を実施できない医療機関で治療を受ける場合等PRIME CAR-Tの使用に適さない場合も含まれます。 |
|
NIB102 |
概要 |
GPC3を標的とする、PRIME技術を活用した当社の自家CAR-T細胞療法パイプラインであり、武田薬品との共同研究開発契約で設定されていたオプション権の行使により、武田薬品に導出されました。 |
|||||||||||||||||
|
開発状況 |
現在、第I相臨床試験を実施中です(※)。治験実施者により公表されている治験の概要は以下の通りです。
|
||||||||||||||||||
|
今後のステップ |
開発の方針については、導出先である武田薬品が決定致します。 |
||||||||||||||||||
|
対象となり得る患者について |
標準治療に不応・不適もしくは不耐であり、GPC3の発現が確認された固形がん患者(肝細胞がん、胃がん、肺扁平上皮がんなどを含む)がNIB102の対象となり得ると考えます。ただし、これらの患者全てにPRIME CAR-Tが使用できる訳ではなく、病状や治療期間の問題等から治療を選択しない場合や、設備の問題等により治療を実施できない医療機関で治療を受ける場合等PRIME CAR-Tの使用に適さない場合も含まれます。 |
※2022年11月に開催された第37回米国がん免疫療法学会において、武田薬品よりNIB102の第Ⅰ相臨床試験の中間結果についてポスター発表が行われました。当該ポスター発表において、第Ⅰ相臨床試験の予備的データは、安全性及び細胞動態、薬力学検討にて推奨的な結果を示しており、用量漸増試験が進行中であることが発表されています。
|
NIB103 |
概要 |
Mesothelin(MSLN)を標的とする、PRIME技術を活用した当社の自家CAR-T細胞療法パイプラインであり、武田薬品へライセンスアウトしました。 |
|||||||||||||||||
|
開発状況 |
現在、第I相臨床試験を実施中です。治験実施者により公表されている治験の概要は以下の通りです。
|
||||||||||||||||||
|
今後のステップ |
開発の方針については、導出先である武田薬品が決定致します。 |
||||||||||||||||||
|
対象となり得る患者について |
標準治療に不応・不適もしくは不耐であり、Mesothelinの発現が確認された固形がん患者(トリプルネガティブ乳がん、大腸直腸がん、卵巣がん、膵臓がんなどを含む)がNIB103の対象となり得ると考えます。ただし、これらの患者全てにPRIME CAR-Tが使用できる訳ではなく、病状や治療期間の問題等から治療を選択しない場合や、設備の問題等により治療を実施できない医療機関で治療を受ける場合等PRIME CAR-Tの使用に適さない場合も含まれます。 |
|
NIB104 |
概要 |
固形がんの標的抗原に対するPRIME技術を活用した当社の自家CAR-T細胞療法パイプラインです。 |
|
開発状況 |
第I相臨床試験開始に向けて、基礎研究を実施中です。 |
|
|
提携状況 |
NIB104については、非臨床試験の段階まで自社で開発を進め、その後適切な段階で製薬企業にライセンスする方針です。現時点において、商業化に係る権利は全て当社が保有しております。 |
|
NIB105 |
概要 |
固形がんの標的抗原に対するPRIME技術を活用した当社の自家のCAR-T細胞療法パイプラインです。 |
|
開発状況 |
第I相臨床試験開始に向けて、基礎研究を実施中です。 |
|
|
提携状況 |
NIB105については、非臨床試験から臨床試験の段階まで自社で開発を進め、その後適切な段階で製薬企業にライセンスする方針です。現時点において、商業化に係る権利は全て当社が保有しております。 |
|
ADAP01 |
概要 |
Adaptimmune Therapeutics plcが選定した標的抗原に対する、PRIME技術を活用した自家のTCR-T細胞療法の共同研究開発パイプラインです。 |
|
開発状況 |
秘密保持契約の該当事項であるため非開示とさせていただきます。 |
|
|
提携状況 |
Adaptimmune Therapeutics plcが全世界における独占的ライセンスを有します。 |
|
|
契約先から見込める収益について |
当社は、Adaptimmune Therapeutics plcよりアップフロント及び進捗に応じたマイルストン収入、また、上市後の売上高に応じたロイヤリティを受け取る権利を有しております。 |
|
AUTL01 |
概要 |
Autolus Therapeutics plcが選定した標的抗原に対する、PRIME技術を活用した自家のCAR-T細胞療法の共同開発パイプラインです。 |
|
開発状況 |
秘密保持契約の該当事項であるため非開示とさせていただきます。 |
|
|
提携状況 |
Autolus Therapeutics plcが全世界における独占的ライセンスを有します。 |
|
|
契約先から見込める収益について |
当社は、進捗に応じたマイルストン収入、また、上市後の売上高に応じたロイヤリティを受け取る権利を有しております。 |
(8)知的財産権(特許等)について
当社は医薬品の研究開発を行っており、知的財産権は重要な経営資源となります。当社が出願人である又は当社がライセンスを有する登録済もしくは出願中の主な重要特許は次のとおりであります。
|
発明の名称 |
発明の内容 |
出願人 |
出願国 |
特許又は出願番号 |
|
CAR発現ベクター及びCAR発現T細胞 |
PRIME技術に関する発明 |
山口大学 |
日本 米国 欧州 他 21か国 |
特許第6161098号 10,316,102 3205720 他 |
|
免疫機能制御因子を発現する免疫担当細胞及び発現ベクター |
PRIME技術に関する発明 |
山口大学 |
日本 米国 欧州 他 20か国 |
特許第6561372号 11,337,997 17766732.6 他 |
|
キメラ抗原受容体 |
パイプラインに関する発明 |
当社 |
日本 米国 欧州 他 17か国 |
特許第6761113号 16/497,291 18774459.4 他 |
|
抗GPC3抗体 |
パイプラインに関する発明 |
当社、 山口大学、 国立がん研究センター |
日本 米国 欧州 他 16か国 |
特許第6579640号 16/472,356 18738824.4 他 |
|
ヒトメソセリンを特異的に認識する細胞表面分子、IL-7、及びCCL19を発現する免疫担当細胞 |
パイプラインに関する発明 |
当社 |
日本 米国 欧州 他 19か国 |
特願2017-247109 16/956,855 18892953.3 他 |
※1 当社は、日本国内で特許出願を行うとともに、PCT(Patent Cooperation Treaty:特許協力条約)国際出願制度を利用しております。PCT国際出願制度の下では、日本特許庁に対して国際出願を行うことで、その時点で有効な全てのPCT加盟国に対して国内出願を行ったのと同じ扱いを得ることができます。また、PCTに基づき、国際調査又は国際予備審査を受けることで、各国における特許取得の可能性を事前に精査することができ、コストの効率化・適正化に繋がります。
(9)用語説明
|
No. |
用語 |
解説 |
|
※1 |
固形がん |
塊を作って増殖するがんであり、がんの中で血液がん以外のものを指す。患者数では、がん全体の約9割を占める |
|
※2 |
CAR-T細胞療法 |
CARは Chimeric Antigen Receptorの略であり、キメラ抗原受容体と訳される。CAR-T細胞療法はCARを発現するように改変されたT細胞を患者に投与することにより難治性のがんを治療する方法 |
|
※3 |
PRIME技術 |
Proliferation-inducing and migration-enhancing技術の略で、がん免疫細胞療法の効果向上のため、特定のサイトカインとケモカインを免疫細胞に遺伝子導入して発現させる技術であり、当社創業者・代表取締役である玉田耕治らによって開発された技術 |
|
※4 |
Unmet medical needs |
いまだに治療法が見つかっていない疾患に対する医療ニーズのことであり、例として難治性のがんに対する治療法などが代表的 |
|
※5 |
免疫チェックポイント阻害薬 |
免疫細胞にブレーキ(抑制)をかけることが知られているPD1/PD-L1, CTLA-4/B7 などの免疫チェックポイント分子に対して阻害効果を有する物質であり、がんに対する免疫細胞の働きを亢進させることでがん治療効果を発揮する薬剤 |
|
※6 |
T細胞 |
血液中に存在する白血球に含まれるリンパ球の一種であり、がんに対する免疫の攻撃において重要な役割を担う。CAR-T細胞製造のもととなる細胞 |
|
※7 |
遺伝子改変技術 |
細胞の遺伝子を操作して、新たな遺伝子を加えたり、既存の遺伝子を除いたりすることで細胞の機能を調節する技術 |
|
※8 |
がん抗原 |
がん細胞にのみ発現する分子や、正常細胞と比べてがん細胞で多く発現する分子の総称であり、がん免疫療法の標的となるもので、がんの目印とも言われる分子 |
|
※9 |
人工的受容体 |
生体が元来持っている分子とは異なり、新しいアミノ酸配列を有する蛋白として人工的に合成された細胞膜表面分子 |
|
※10 |
血液がん |
血液細胞が骨髄から分化していく過程のどこかにおいて細胞ががん化することによって生じるがんであり、患者数ではがん全体の約1割を占める |
|
※11 |
サイトカイン |
免疫細胞に対して活性化や抑制、分化などの調節作用を有する物質の総称 |
|
※12 |
ケモカイン |
免疫細胞の体内での動きや臓器への浸潤を調節する機能を有する物質の総称 |
|
※13 |
抗原提示細胞 |
がん抗原をT細胞に提示して、がん細胞に対するT細胞の活性化を誘導する機能を有する免疫細胞のこと |
|
※14 |
樹状細胞 |
抗原提示細胞の一種であり、細胞表面に突起を多数有するため、樹状細胞と呼ばれる。抗原提示細胞の中でもT細胞の活性化を誘導する能力が特に高く、がんに対する免疫反応の誘導において重要な役割を有する細胞 |
|
※15 |
エピトープスプレッディング(エピトープ拡大) |
がん細胞が死滅した際にがん抗原が細胞外に放出され、それを樹状細胞が取り込んでT細胞に提示することにより、がんに対して攻撃性を有するT細胞が次々と活性化する現象のことであり、固形がんに対する効果的な免疫治療のためには極めて重要とされている現象 |
|
※16 |
メモリーT細胞 |
活性化したT細胞の一部が生体内で長期間生存し、特定の抗原に対する反応性を保持し続けた状態のT細胞のことで、記憶T細胞とも呼ばれる細胞 |
|
※17 |
ナイーブT細胞 |
抗原にさらされたことのないT細胞のこと。抗原提示細胞からの抗原刺激を受けることにより、活性化され、機能分化してTh1細胞やTh2細胞などのエフェクターヘルパーT細胞に分化する細胞 |
|
No. |
用語 |
解説 |
|
※18 |
樹状細胞 |
抗原提示細胞の一種であり、細胞表面に突起を多数有するため、樹状細胞と呼ばれる。抗原提示細胞の中でもT細胞の活性化を誘導する能力が特に高く、がんに対する免疫反応の誘導において重要な役割を有する細胞 |
|
※19 |
遊走 |
細胞などが個体内のある位置から別の位置に移動すること |
|
※20 |
トランスウェル |
ボイデン・チャンバーとも呼称される。細胞遊走を定量化する簡易測定において使用される細胞培養容器 |
|
※21 |
抗CD3抗体 |
T細胞に発現するCD3分子に結合して刺激し、活性化するための抗体試薬 |
|
※22 |
リンパ組織 |
リンパ節や脾臓のように、リンパ球の集まりによって出来ている組織のこと |
|
※23 |
CD20 |
当社の実験モデルにおいて、CARの標的として腫瘍細胞の細胞膜上に発現させた分子の名称 |
|
※24 |
肥満細胞腫 |
免疫系を構成する細胞の一種である肥満細胞ががん化することにより形成された腫瘍細胞株 |
|
※25 |
P815-CD20 |
肥満細胞腫であるP815にCARターゲットのCD20分子を発現させた腫瘍細胞株 |
|
※26 |
免疫不全マウス |
免疫細胞を欠損したマウスのことであり、拒絶反応を起こさないため、ヒトのがん細胞や免疫細胞を接種することが可能であり、ヒトT細胞の体内での機能を解析する実験に使用されるマウス |
|
※27 |
用量制限毒性 |
薬剤を投与する臨床試験において、これ以上の増量ができない理由となる毒性のこと |
|
※28 |
サイトカイン放出症候群 |
過剰な免疫反応に伴って細胞から多量のサイトカインが放出され、血中のサイトカイン濃度が高度に上昇することを原因として引き起こされる病態 |
|
※29 |
神経毒性 |
薬の投与に伴い、中枢神経や末梢神経の構造や機能に障害を及ぼす毒性 |
|
※30 |
SD (Stable Disease) |
薬剤の投与後に評価対象の腫瘍の直径が30%以上縮小せず、20%以上増大もせず、かつ新しい腫瘍も生じない場合 |
|
※31 |
PD(Progressive Disease) |
薬剤の投与後に評価対象の腫瘍の直径が20%以上増大する、又は1か所以上の新しい腫瘍が生じる場合 |
|
※32 |
AFP (Alpha Fetoprotein) |
肝細胞がんにおいて血中の濃度が上昇する蛋白であり、肝細胞がんの診断や治療効果判定として用いられる指標 |
|
※33 |
LDH (Lactate Dehydrogenase) |
肝臓や心臓など、体のさまざまな細胞でつくられる蛋白で、肝細胞がんを含めた悪性腫瘍で血液中の濃度が上昇する場合があり、診断や治療効果判定として用いられる指標 |
|
※34 |
疾患バイオマーカー |
がんやその他の疾患において、病気の進行に伴って数値が上昇し、診断や治療効果判定の指標となる生体内の物質 |
|
※35 |
標的分子 |
がんの目印となり、治療の標的となるたんぱく質などのある特定の分子 |
|
※36 |
PD-1シグナル |
免疫細胞に発現するPD-1分子を介して伝達され、免疫細胞の機能を抑制するシグナル |
|
※37 |
PD-1抗体 |
免疫チェックポイント分子であるPD-1を阻害することでがん細胞による免疫細胞への抑制機能を阻害し、免疫細胞によるがん細胞への攻撃能力を高める働きをする抗体(チェックポイント阻害剤) |
|
※38 |
TCR-T細胞療法 |
TCRはT-Cell Receptorの略であり、T細胞受容体と訳される。CAR-T細胞療法と同様に難治性のがんを治療する方法 |
|
※39 |
腫瘍溶解性ウイルス |
がん細胞に感染することで、がん細胞を死滅させるウイルスの総称 |
|
No. |
用語 |
解説 |
|
※40 |
NK細胞 |
自然免疫系に属する免疫細胞の一種で、標的細胞を傷害するナチュラルキラー活性を有する細胞 |
|
※41 |
γδ型T細胞 |
T細胞の一種であり、γδ型のT細胞受容体を発現し、炎症などの免疫応答において機能を発揮する細胞 |
|
※42 |
TIL療法 |
腫瘍浸潤リンパ球(Tumor-infiltrating lymphocyte:TIL)を用いたがん治療法のことであり、患者のがん組織内に集まっているTILを採取し、それらを培養・活性化して増やした後にがん患者に投与する方法 |
|
※43 |
iPS細胞 |
人工多能性幹細胞(induced pluripotent stem cells:iPS cells)のことであり、体細胞へ数種類の遺伝子を導入することで、様々な細胞に分化できる分化万能性と、分裂増殖を経てもそれを維持できる自己複製能を持たせた細胞 |
|
※44 |
自家 |
患者自身の細胞 |
|
※45 |
他家 |
健康な細胞提供者(ドナー)から採取した細胞 |
|
※46 |
ゲノム編集技術 |
生物が持つ遺伝子の中の目的とする場所を高い精度で切断したり、挿入したりする技術であり、特定の遺伝子が担う形質を改良することが可能となる技術 |
|
※47 |
CRISPR-CAS3 |
標的DNA配列に結合するガイドRNAとDNA切断活性を有するCAS3蛋白により細胞内のDNAを切断し、編集できる技術 |
|
※48 |
非盲検、非ランダム化 |
臨床試験の担当医師も参加者にも投与される医薬品、用量などをオープンにして実施される臨床試験 |
|
※49 |
CAR陽性生細胞数 |
CAR遺伝子の導入・発現が確認される生きたT細胞の数 |
4【関係会社の状況】
|
名称 |
住所 |
資本金 (百万円) |
主要な事業の内容 |
議決権の所有割合又は被所有割合(%) |
関係内容 |
|
(その他の関係会社) |
|
|
|
|
|
|
武田薬品工業株式会社 (注) |
大阪市 中央区 |
1,676,263 |
医薬品等の研究開発、製造、販売、輸入 |
被所有 20.5 |
ライセンス先 研究施設の賃借 |
(注)有価証券報告書を提出しております。
5【従業員の状況】
(1)提出会社の状況
|
|
|
|
|
2023年4月30日現在 |
|
従業員数(名) |
平均年齢(歳) |
平均勤続年数(年) |
平均年間給与(千円) |
|
|
|
( |
|
|
|
(注)最近日までの1年間において従業員数が5名増加しております。主な理由は、事業進捗に伴う業務拡大に対応するため期中採用が増加したことによるものであります。
|
事業部門の名称 |
従業員数(名) |
|
|
事業企画研究部 |
9 |
(5) |
|
開発部 |
6 |
(1) |
|
管理部 |
7 |
(0) |
|
合計 |
|
( |
(注)1.従業員数は就業人員であり、常用の契約社員を含んでおります。臨時雇用者数(人材会社からの派遣社員を含みます。)は、最近1年間の平均人員を( )外数で記載しております。
2.平均年間給与は、賞与及び基準外賃金を含んでおります。
3.当社は、がん免疫療法創薬事業の単一セグメントであるため、事業部門別の人数を記載しております。
(2)労働組合の状況
当社において労働組合は結成されておりませんが、労使関係は円満に推移しております。