第二部 【企業情報】
第1 【企業の概況】
1 【主要な経営指標等の推移】
(注) 1.当社は連結財務諸表を作成しておりませんので、連結会計年度に係る主要な経営指標等の推移については記載しておりません。
2.売上高には、消費税等は含まれておりません。
3.持分法を適用した場合の投資利益については、関連会社を有していないため記載しておりません。
4.第17期の資本金の減少は、欠損填補を目的とする無償減資によるものであります。
5.2018年3月30日を払込期日とする第三者割当増資により普通株式119,510株を発行しております。
6.第16期の潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、当社株式は非上場であるため、期中平均株価が把握できませんので、記載しておりません。第17期及び第20期の潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、当社株式は非上場であるため、期中平均株価が把握できませんので、また、1株当たり当期純損失であるため記載しておりません。第18期及び第19期の潜在株式調整後1株当たり当期純利益については、1株当たり当期純損失であり、また、潜在株式が存在しないため記載しておりません。
7.第17期、第18期、第19期及び第20期の自己資本利益率は、当期純損失であるため記載しておりません。
8.株価収益率については、当社株式は非上場であるため、記載しておりません。
9.1株当たり配当額及び配当性向については、無配のため、記載しておりません。
10.第16期及び第17期については、キャッシュ・フロー計算書を作成していないため、キャッシュ・フローに係る各項目については、記載しておりません。
11.主要な経営指標等の推移のうち、第16期及び第17期については、会社計算規則(平成18年法務省令第13号)の規定に基づき算出した各数値を記載しており、金融商品取引法第193条の2第1項の規定による監査証明を受けておりません。
12.第18期、第19期及び第20期の財務諸表については、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、有限責任 あずさ監査法人により監査を受けております。
13.2019年12月11日付で普通株式1株につき30株の割合で株式分割を行っております。第19期の期首に当該株式分割が行われたと仮定し、1株当たり純資産額及び1株当たり当期純損失を算定しております。
14.当社は、2019年12月11日付で普通株式1株につき30株の株式分割を行っております。
そこで、東京証券取引所自主規制法人(現 日本取引所自主規制法人)の引受担当者宛通知「『新規上場申請のための有価証券報告書(Ⅰの部)』の作成上の留意点について」(平成24年8月21日付東証上審第133号)に基づき、第16期の期首に当該株式分割が行われたと仮定して算出した場合の1株当たり指標の推移を参考までに掲げると、以下のとおりとなります。
なお、第16期及び第17期の数値(1株当たり配当額についてはすべての数値)については、有限責任 あずさ監査法人の監査を受けておりません。
2 【沿革】
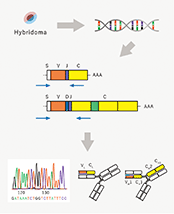
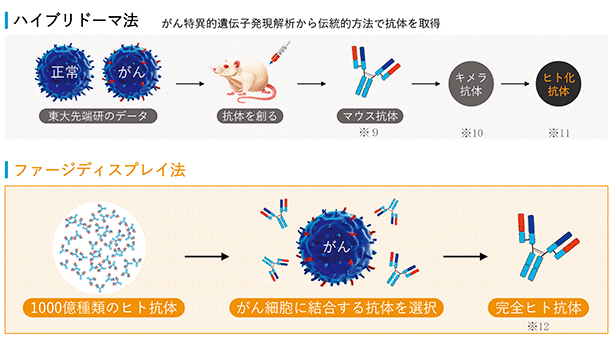
当社は、2001年2月に東京大学先端科学技術研究センター・システム生物医学ラボラトリー(LSBM)で開発された蛋白質発現・抗体(注1)作製技術を基盤として、診断・創薬標的に対応する抗体の医療への活用を目指して設立されました。
(注) 1.抗体:抗原(免疫反応を引き起こす物質)の構造に応じて1対1の関係で特異的に結合する蛋白質。この特異的な結合力を利用して、がんや感染症、疾患を診断・治療する医薬品(分子標的薬)に応用されます。
2.放射性同位体:放射線を放出する同位体(同じ陽子数で中性子数が異なるものを同位体という)。
3 【事業の内容】
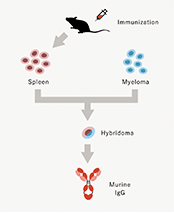
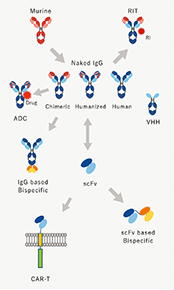
当社は東京大学先端科学技術研究センター・システム生物医学ラボラトリー(LSBM)で開発された蛋白質発現・抗体(※1)作製技術を基盤として、診断・創薬標的に対応する抗体の医療への活用を目指して設立されました。創業以来、医薬品シーズ(※2)抗体を創生することで、がん及びその他疾患の治療用医薬品の研究開発、及び関連業務を行っております。LSBMで開発された蛋白質発現技術により、従来は作製することが困難だった標的蛋白質も免疫することが可能となり、そのような標的蛋白質に対する抗体の取得がより容易になりました。これをハイブリドーマ法(動物免疫法)(※3)と組み合わせることで、親和性(※4)の高い抗体の効率的な取得を可能にしています。さらに、当社は多様性に富むファージ抗体ライブラリ(※5)と特許技術でもある独自の抗体スクリーニング(※6)技術を保有しており、対象とする疾患の細胞に適用することで、創薬標的の探索と従来のハイブリドーマ法で得られるものとは異なる特徴を持つ高機能シーズ抗体の同時取得を可能にしています。当社の技術は、これら二つの抗体技術とシーズ探索術を融合し、医療ニーズにマッチした医薬品シーズ抗体を取得することを特長としております。また、当社は東京大学発であることを起点として、さらにそのネットワークを広げ、多くのアカデミアとの連携により「最先端の抗体技術で世界の医療に貢献する」ことを企業理念としております。
<シーズ探索のアプローチ>
当社は以下の二つのアプローチによりシーズ探索を行っています。一つは、動物に免疫して取得する一般的なハイブリドーマ法です。臨床試験進行中のグリピカン3(PPMX-T001)やカドヘリン3(PPMX-T002)はこの手法で同定(※7)されました。もう一つは、動物を用いずに抗体を取得するファージディスプレイ法(※8)です。この手法は創薬標的の同定とがん特異的な抗体の探索を同時に行うことができる方法です。
世界におけるバイオ医薬品市場の推移を見ると、年々バイオ医薬品の売上高は増加しており、2019年には約2,660億ドル(バイオ医薬品比率29%)に達しました。今後も売上の増加が見込まれており、2026年には約5,050億ドル(バイオ医薬品比率35%)に達するとも予測されています。(出典:EvaluatePharma® World Preview 2020, Outlook to 2026)
また、2019年度の世界の医薬品の売上高上位10品目のうち、抗体医薬品(※13)は1位も含めて4品目を占めております(出典:日経BP社 「日経バイオテク」の調査データ)。
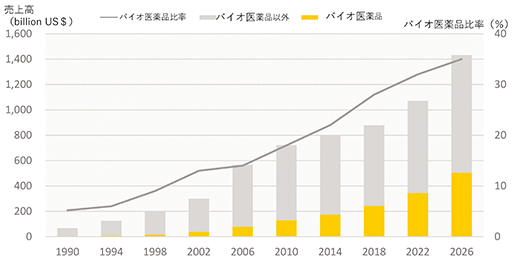
(出所:EvaluatePharma® World Preview 2020, Outlook to 2026を基に当社作成)
このような事業環境の中で、当社は機能性の高い抗体を当社独自の技術で作製し治療薬として開発しているほか、抗体に放射性同位体や毒素を化学的に結合させ、がん細胞への攻撃力を高める治療薬の研究開発も行っております。
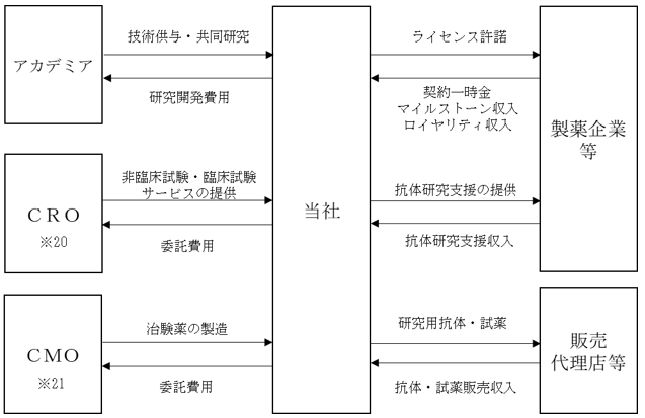
(1) 当社の事業モデル
当社の事業セグメントは、医薬品事業のみの単一セグメントでありますが、以下の各分野において製品化に向けた研究開発、ライセンス、製造方法の確立に取り組んでおります。
① 創薬
当社は、長年の経験に基づいたハイブリドーマ法と、独自のスクリーニング技術を取り入れたファージディスプレイ法により、高機能抗体を取得したうえで、必要により抗体に遺伝子工学的な改変あるいは化学的な修飾を施し、抗体医薬品候補としての研究開発を進めております。
創薬の収益モデルは、国内外の製薬企業に対して、当社が開発した医薬候補品を導出(特定の医薬品を開発、販売するために必要な知的財産権の使用を許可すること。)することによる契約一時金収入、開発の進捗に応じて支払われるマイルストーン収入、上市(※14)後に売上高の一定割合が支払われるロイヤリティ収入等を獲得することであります。
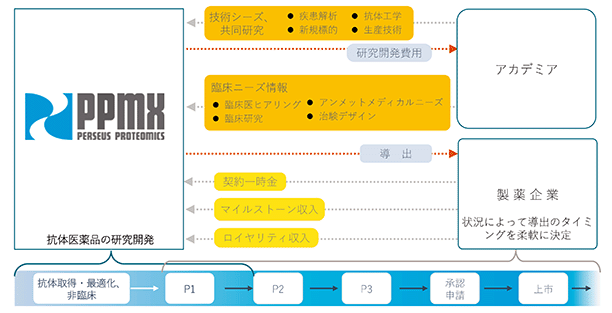
当社は、これまでに創出したがん治療用抗体のうち、肝臓がんを標的とする抗体及び固形がんを標的とする放射性同位体標識抗体を、それぞれ製薬企業である中外製薬株式会社及び富士フイルム株式会社に導出し、現在、導出先により臨床試験が行われております。また、難治性血液がんを標的とした抗体は、2014年に国立研究開発法人科学技術振興機構(JST)の研究成果最適展開支援プログラム(A-STEP)に採択され、開発を進め、2018年より企業主体の開発に切り替えて自社で治験を推進中です。さらに、難治性固形がんを標的としたADC(※15)等、数々のがん治療用抗体の研究・開発を進めております。
なお、当社における抗体創薬の特長は、医薬品として高い薬理効果が期待できる新規抗体を効率的に取得することです。この抗体の物質特許が事業のベースになり、その抗体を医薬品として患者さんに届けるべく非臨床試験、臨床試験及び薬事承認を得るまで如何に早く進めるかが課題となります。導出は、一般的に、特許取得後すぐに大手製薬企業に導出するケース、自社で非臨床試験を完了してから導出するケース、自社単独であるいはパートナー企業と共同で臨床試験を実施し、パイプラインの価値を高めてから製薬企業に導出するケース等があります。この導出の形態は、薬剤の特性、薬剤ごとに異なる臨床試験の計画、適応疾患及び開発費用等を勘案して決定いたします。
近年、抗体医薬品の認知度が高まる中、多数の抗体医薬品が上市され、抗体医薬品ビジネスの競争も激化しつつあります。これに伴い非臨床段階では有利な経済条件で導出することが難しくなりつつあります。当社は、抗体医薬品を早期に患者さんに届けるため自社でも積極的に臨床試験を実施し、製薬企業に導出していくことを推進してまいります。
本書提出日現在においては、導出済みの3抗体に続く薬剤候補である抗トランスフェリン受容体抗体の開発に集中するとともに、新規抗体のシーズ探索を行っております。新規抗体に関しては、当社の保有するファージ抗体ライブラリを探索した結果、複数の候補が見つかっております。また、新規標識との組合せによるADC化等の研究も進んでおります。
なお、各開発品の詳細については、後述「(3) 当社の開発品」をご参照ください。
② 抗体研究支援
当社は、これまでにがん等を対象とした抗体医薬品や研究用試薬の創出を通じて培ってきた技術や経験を活かして、抗体に関連した研究支援(研究受託)を実施しております。特にアカデミアや製薬企業に対する抗体研究支援は、当社の創薬活動におけるネットワークの広がり等のシナジー効果があります。
a.抗体作製
動物細胞を利用した組換え蛋白質の生産系を利用して、薬効を確認する試験に使用することが可能な程度に高度に調製したIgG型抗体(※16)の作製を行います。一般にマウスなどを対象とした動物試験で使用する抗体の必要量は数十mg程度ですが、一般の試薬会社では100ug単位で販売されるのに対し、組換え蛋白質として抗体の生産を委託会社に依頼した場合、数g単位のような過剰量であることも多く費用が高額になりがちです。それに対し、当社は生産量にフレキシブルに対応することが可能です。
b.研究受託
抗体は物理的な安定性や薬理的な効果など様々な観点での試験が行われ、その用途に応じて、最適な抗体が選択される必要があります。当社ではこれまでに培った抗体解析・評価ノウハウをもとに、ある標的に対して得られる多数の抗体群の中から、診断・治療に適した抗体を選別・提供するような研究受託を行います。また前述した抗体作製で作製した抗体などを利用して薬効試験を代行・コンサルティングするなど、当社の抗体開発経験をもとにした各種サービスを提供することで、大学等の研究を支援致します。
c.配列解析
抗体産生細胞(ハイブリドーマ、一般に一種類のマウス抗体を産生する)から、抗体配列(※17)を取り出しその遺伝子配列を決定します。抗体の遺伝子配列は様々な標的との結合が可能となるように多様な組み合わせの配列を生成するという特有の特殊性を持つため、通常の配列決定法では一意に遺伝子配列を決めることが困難ですが、当社は独自に設計した遺伝子増幅用配列を用いることで、その抗体配列情報を解析することが可能です。そして、この解析を行うことでこの結果をもとにした特許出願を行ったり、前述した組換え蛋白質として抗体作製に用いたりすることが可能となります。
③ 抗体・試薬販売
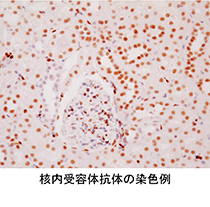
当社では、がんや生活習慣病等、各種疾患のバイオマーカー(※18)となる核内受容体抗体を全48種類取り揃えており、世界の研究者に向けて研究用試薬として販売しております。また、PTX3 ELISAキット(※19)の開発に成功し、研究用試薬として販売しております。
<事業系統図>
(2) 当社の技術
治療用抗体を取得するために、当社では①抗体探索、②抗体工学、③標的探索、④機能性蛋白質発現の各技術を保有しております。
① 抗体探索
抗体を取得する方法として、当社ではファージディスプレイ法とハイブリドーマ法を保有しております。また、ファージディスプレイ法によって取得した抗体をスクリーニングする技術として、当社独自の手法であるICOS法(Isolation of antigen/antibody Complexes through Organic Solvent method、特許第4870348号)を保有しております。
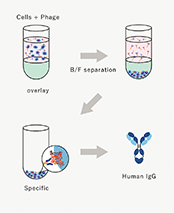
a.ファージディスプレイ法
動物を用いない抗体取得方法として、以下の2つの抗体ライブラリから特定の標的分子と結合する抗体配列を選別します。当社は、保有する抗体ライブラリと独自のスクリーニング技術を組み合わせることで、薬剤となりうる抗体を取得しています。優れた抗体とは狙った標的分子のみに強く結合する性質を持ち、これを特異性(※22)、高親和性と呼びます。またその性質により標的分子の機能を制御する場合は機能性抗体と呼ばれ、抗体医薬品においては重要な性能となります。
(3) 当社の開発品
当社の開発パイプラインの進捗状況は以下のとおりです。
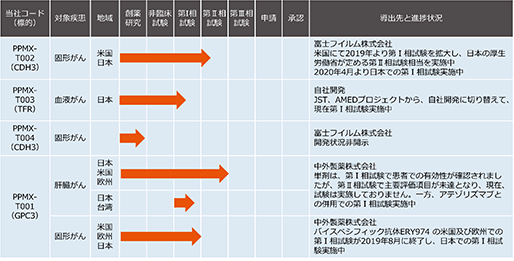
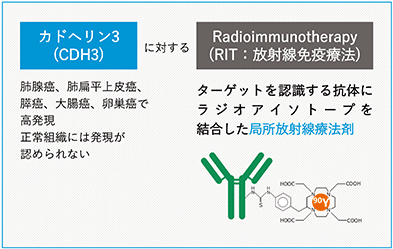
① PPMX-T002
富士フイルム株式会社 開発コード:FF-21101
b.開発状況
富士フイルム株式会社が米国にて2016年より進行性固形がん患者さんに対する抗がん剤として、第Ⅰ相試験を開始し、投与された患者さんでPPMX-T002の抗体が、がん組織に集積すること、及び安全性が確認された用量で一部症例において腫瘍の縮小が確認されました。ステージ4の患者さんを対象にした臨床試験で、15例中11例でSD又はCRという好成績が得られています。また、CRの症例では投与後、次第に腫瘍が小さくなり26か月後には卵巣がんが消失した症例(CR)がありました。
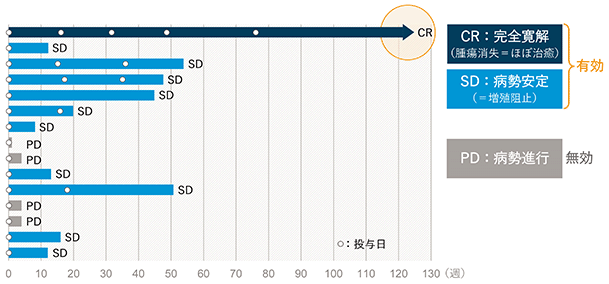
(出典 Subbiah et al. (2017) AACR Annual Meeting, Chicago, USA DOI: 10.1158/1538-7445.AM2017-
CT097)
米国において2019年より第Ⅰ相試験を拡大し、最大耐容用量で症例数を増やした拡大第Ⅰ相試験(日本の厚生労働省の定める第Ⅱ相試験相当)を実施中です。なお、拡大第Ⅰ相試験は、患者さんを増やして、多くの症例を得ることができ、その後の第Ⅱ相試験をコンパクトに実施可能となるため、近年、米国におけるがん治療薬候補においては、拡大第Ⅰ相試験が実施されるケースが増加しています。また、国内での第Ⅰ相試験も2020年4月より開始しました。
<海外におけるPPMX-T002(導出先での名称:FF-21101)の臨床試験>
<国内におけるPPMX-T002(導出先での名称:FF-21101)の臨床試験>
c.対象疾患
CDH3陽性難治性固形がん(卵巣がん、胆道がん、頭頸部扁平上皮がん)
d.ライセンスの状況
2011年1月に、当社及び富士フイルムRIファーマ株式会社(現 富士フイルム富山化学株式会社)のPPMX-T002に関する権利(「研究・開発」及び「製造・販売」等)を富士フイルム株式会社に実施許諾する契約を締結しました。
② PPMX-T003
a.特徴
PPMX-T003は、ファージディスプレイ法により取得された抗体で、トランスフェリン受容体(TfR)を標的とします。TfRは、鉄を結合したトランスフェリンを細胞内に取り込むため、細胞膜上に発現しています。細胞の生存には細胞内への鉄取り込みが必須であり、赤血球のもとになる赤芽球と増殖盛んな全てのがん細胞でTfRが高発現していることが古くから広く知られています。鉄の取り込みを阻害することで細胞内の鉄を枯渇させ、がん細胞を死滅させるという試みが、古くから行われてきました。これまでに数多の研究者が抗TfR抗体の研究開発に取り組んできましたが、臨床で使用可能な抗体は未だ見出されておりません。こうした中、当社は、当社独自のスクリーニング技術であるICOS法を取り入れたファージディスプレイ法で極めて高い鉄取り込み阻害能を示す完全ヒト抗体を取得しました。現在、幅広い血液疾患を対象とした治療薬の開発を計画しており、まずは真性多血症(PV:Polycythemia Vera)に対する治療薬開発を目指して、2019年11月から臨床試験を実施しています。
下の中央図は、PPMX-T003が、ブロッキング抗体としてTfRからの鉄結合蛋白質の取り込みを阻害する様子を表しています。右のグラフは、トランスフェリン受容体に対する結合阻害率を評価した競合アッセイデータです。横軸は濃度で左に行くほど結合が強く(低濃度で阻害する)、下に行くほど結合阻害率が高いことを示します。体内にあるトランスフェリンと比較して、PPMX-T003は、100倍以上結合が強いこと、また、完全に結合阻害していることがわかります。A24は従来の抗体で、結合力も弱く阻害率が半分にも到達していません。
<がん細胞の鉄の取込みを阻害すると細胞死・増殖抑制するイメージ図、及びPPMX-T003の結合活性を従来の抗体と比較したデータ>
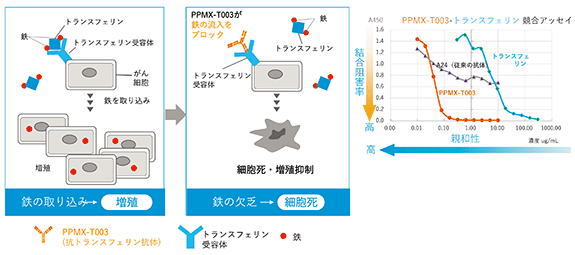
PPMX-T003は、当社独自技術ICOS法により取得したユニークなヒト抗体であり、TfRに結合することでがん細胞の鉄の取り込みを阻害し、強力な抗腫瘍効果を示しております。これにより、化学療法剤で生じるような患者さんの大幅なQOL(※32)低下を伴わない治療効果が期待されます。また、試験管内で幅広い種類の血液がんに抗腫瘍効果を発揮し、各種マウスモデルでがん縮小/延命効果を発揮いたしました。
以下のデータ(表)は様々な血液がん細胞に対する増殖抑制効果のデータです。一番下の正常細胞(臍帯由来細胞)に対して、最下段以外の全てが種々のがん細胞で、そのEC50(細胞増殖を50%抑制するために必要な薬剤濃度)は2桁以上少なく、がん細胞が正常細胞に比較してPPMX-T003に敏感で、強く増殖抑制されることが判ります。
<正常細胞に対してがん細胞に強く作用するPPMX-T003の細胞増殖抑制の比較データ(表)>
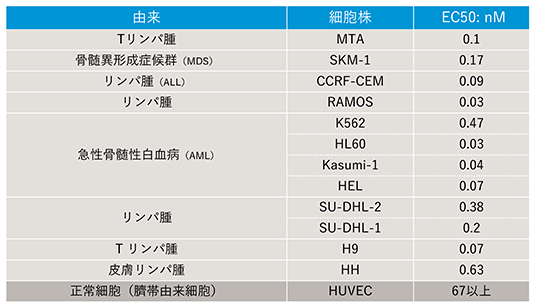
(注)細胞株とは、がん組織から採取し、安定的に増殖・培養できるようにした実験用細胞のこと
以下のデータは担癌マウスを用いた動物実験データです。急性骨髄性白血病(AML)や悪性リンパ腫で薬剤の用量依存的にがん細胞の増殖が抑制されていることが判ります。いずれも横軸は日数、縦軸は腫瘍の大きさで、矢印は薬剤の投与を表しています。二つのグラフはいずれも、薬剤無し(Control)で日数と共に急速に腫瘍体積が大きくなっています。これに対してPPMX-T003を投与すると、投与量が増えるとともに腫瘍体積の増大が抑制されています。特に30日目以降は、その後に薬剤の投与が行われていないのに腫瘍体積は増えてきません。つまり、PPMX-T003は用量依存的に腫瘍体積の増加を抑制し、投与量が多い場合はがんを消失していることが確認できました。
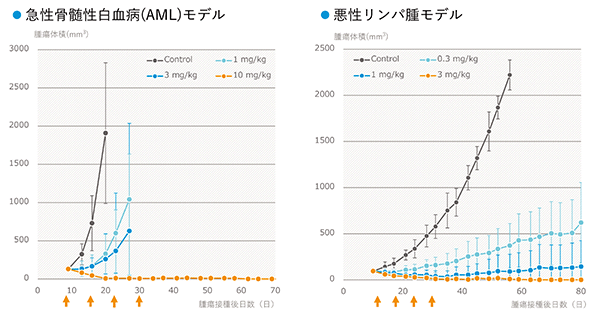
(出典 Zhang et al.(2017) AACR Annual Meeting, Chicago, USA DOI: 10.1158/1538-7445.AM2017-5586)
b.開発状況
国立研究開発法人科学技術振興機構(JST)研究開発成果最適展開支援プログラムの採択後、2018年にサルを用いた非臨床毒性試験(GLP毒性試験)を完了し、2015年に終了した予備試験と同様の結果を得ております。また、本非臨床毒性試験完了をもって研究開発成果最適展開プログラムは終了し、現在、自社単独で治験を実施しております。
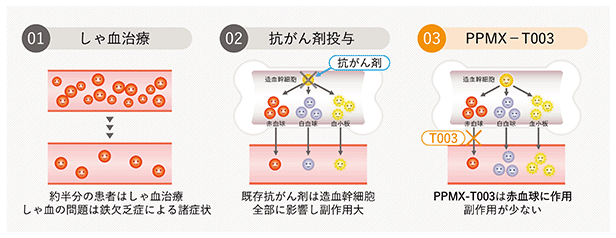
PPMX-T003は種々の血液がんで治療効果が期待されますが、最初に真性多血症治療薬の開発に取り組んでいます。真性多血症は赤血球が通常より多い疾患で血栓生成が問題です。現在の治療法は、瀉血(しゃけつ)又は抗がん剤等の薬物療法です。瀉血は体内の鉄分が不足するため、貧血や脱力感、うつ病、手足むずむず病等の精神症状を伴い、QOLが悪いという課題があります。また、抗がん剤等の既存の薬物療法は骨髄抑制や2次がん発症リスク等の問題があります。これに対して、PPMX-T003は、既存の治療法で問題となる副作用の大幅な低減が期待されます。
以下に真性多血症の標準的治療法と課題について図に示します。
<真性多血症と治療>
以下のデータは、順天堂大学における真性多血症の患者さんの瀉血検体を用いた内因性赤芽球コロニーの増殖試験の結果です。PPMX-T003を加えた細胞培養の実験で、赤芽球コロニーの形成が阻害されていることが判ります。これは、PPMX-T003の真性多血症治療薬としての可能性が、ヒトの検体を用いて検証された、重要な事例です。

(出所:第81回日本血液学会学術集会「抗TfR1抗体による真性多血症内因性赤芽球コロニーの形成阻害」)
2019年11月より真性多血症治療薬としての第Ⅰ相試験を開始し、2021年3月に健常人の第Ⅰ相試験は終了しました。現在患者さんの第Ⅰ相試験の準備中であります。
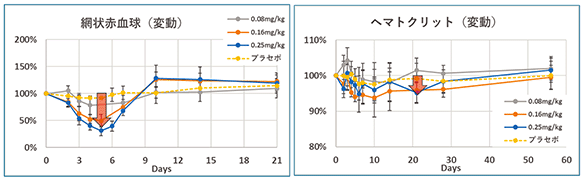
健常人の第Ⅰ相試験は、インフュージョンリアクション(抗体等の投与に伴う発熱等の反応のこと)の対策及び新型コロナウイルス感染拡大の影響により治験が中断したことにより計画より約4カ月遅れで終了しました。健常人の第Ⅰ相試験の、主要目的の安全性では、日本人健康成人男性へのPPMX-T003の投与量0.25mg/Kgまでの単回持続静脈内投与において、安全性が確認されたと考えております。また、以下のデータのようにPPMX-T003の投与により用量依存的に網状赤血球が減少し、ヘマトクリット値も低下しました。これは、PPMX-T003がトランスフェリン受容体を高発現している赤芽球に作用して、網状赤血球が低減したと考えられます。赤血球低下に伴い減少したヘマトクリット値は1か月間に渡り低下しその後回復しました。ヘマトクリット値は血液中の赤血球の割合で、真性多血症ではこの値が大きくなります。(網状赤血球とは、骨髄から末梢血に入ったばかりの幼若赤血球で、1日で成熟赤血球になります。骨髄における赤芽球造血を反映しています。)
真性多血症とは別に、急性骨髄性白血病、悪性リンパ腫等の血液がん及び固形がんの治療薬としての作用機構を明確化するため、名古屋大学、藤田医科大学、群馬大学等と共同で臨床効果に関する創薬研究を推進しております。
c.対象疾患
血液がん
d.ライセンスの状況
本書提出日現在、日本及びグローバルでのライセンスの提携先は決まっておりません。
③ PPMX-T004
a.特徴
PPMX-T004は、がん細胞表面に存在するカドヘリン3(CDH3)を標的とした開発中の治療薬です。CDH3は、細胞間接着蛋白質として機能すると考えられています。PPMX-T004は、遺伝子改変した抗体に薬物を標識した抗体薬剤複合体で、これと結合したがん細胞を標識した薬物で殺傷することができるため、患者さんの免疫機能の状態に関わらず、高い効果が期待できます。PPMX-T004では、固形がんの細胞表面に多く発現しているCDH3を標的とし、がんの細胞に対し高い内在性を有する抗体を用いています。
標的がPPMX-T002と同一であるため、その他の対象疾患もPPMX-T002と同種であることが想定されますが、放射線免疫療法(※33)とは異なり、施設を選ばない点でPPMX-T002との棲み分けが可能であると共に、大きな利便性を持つものと考えています。
b.開発状況
導出先との契約により開発状況は開示できません。
c.対象疾患
CDH3を発現する固形がん
d.ライセンスの状況
富士フイルム株式会社に導出済みです。
④ PPMX-T001
中外製薬株式会社 開発コード等:
「GC33」抗グリピカン3ヒト化モノクローナル抗体 一般名:codrituzumab
「ERY974」抗グリピカン3/CD3バイスペシフィック抗体(※34)
a.特徴
PPMX-T001は、遺伝子チップを用いたトランスクリプトーム解析により見出された、肝臓がんで特異的に発現が高いグリピカン3(GPC3)を標的としております。
LSBMの油谷浩幸教授を中心とするグループでは、DNAマイクロアレイ(※35)を用いてトランスクリプトーム解析を系統的に実施しました。この解析により、肝臓がん組織と正常組織の比較からがんに特異的に発現する遺伝子を捉えることに成功しております。その中の1つの分子がGPC3であり、GPC3は、細胞膜上に存在する約60kDaの糖蛋白質で、グリコシルフォスファチジルイノシトール(GPI)アンカーにより細胞膜に結合しています。トランスクリプトーム解析から、GPC3遺伝子が胎児期の肝臓と肝がん細胞において高発現していることが確認されました。エピトープの異なる複数の抗体を用いて、各種病理標本で組織染色を行った結果、GPC3は肝がん組織に発現している一方で、成人正常肝臓、肝炎及び肝硬変の組織には発現が認められなかったことから、肝臓がん治療薬としての可能性を見出しました。この技術を譲り受けた中外製薬株式会社が、独自に取得した抗体を治療薬として開発しております。
b.開発状況
この開発中の治療薬は、単剤は第Ⅰ相試験で患者さんでの有効性が確認されましたが、第Ⅱ相試験は、主要評価項目が未達となり、現在、試験は実施されておりません。一方、アテゾリズマブとの併用で第Ⅰ相試験を行い、患者さんでの有効性が確認されたことが学会発表されております。さらに、バイスペシフィック抗体 ERY974(抗GPC3-抗CD3)の米国及び欧州での第Ⅰ相試験が、2019年8月に終了し、国内での第Ⅰ相試験を実施中です。
c.対象疾患
肝臓がん
d.ライセンスの状況
2006年9月に、肝臓がんを適応として、中外製薬株式会社との間に抗GPC3抗体の特許を受ける権利等の譲渡に関する契約を締結しました。 本契約には、開発の全部を中止する場合は、事前に又は中止から一ヶ月以内に中外製薬株式会社から通知を受けることになっておりますが、その他の情報の入手については、規定されておらず、限定的になる可能性があります。
なお、当該契約の契約期間は、当該特許の存続期間満了日迄であり、この契約で定めている特許は、次のとおりです。「第2 事業の状況 2 事業等のリスク (3) パイプラインに関するリスク ① PPMX-T001について」をご参照ください。
権利者:中外製薬株式会社
出願番号:PCT/JP2002/006237
⑤ その他
当社は患者組織を利用することで取得した疾患特異的な標的候補を多数保有しております。これら標的群に対する抗体取得を順次進めており、Naked抗体(※36)、ARMED抗体等、多様なプラットフォームを用いた自社開発プログラムを推進中です。
<用語集>
4 【関係会社の状況】
関係会社は次のとおりであります。
(注) 2020年11月10日及び2020年11月30日を払込期日とする第三者割当増資により、富士フイルム株式会社の議決権の所有割合は、35.63%となりました。
5 【従業員の状況】
(1) 提出会社の状況
当社は、医薬品事業の単一セグメントであるため、事業部門別に記載しております。
(注) 1.従業員数は就業人員(社外から当社への出向者を含む。)であります。
2.従業員数欄の(外書)は、臨時従業員の年間平均雇用人員であります。
3.平均年間給与は、基準外賃金を含んでおります。
(2) 労働組合の状況
当社の労働組合は、結成されておりませんが、労使関係は円満に推移しております。