第二部 【企業情報】
第1 【企業の概況】
1 【主要な経営指標等の推移】
(1) 連結経営指標等
(注)1.事業収益には、消費税等は含まれておりません。
2.当社は、2019年11月29日開催の取締役会決議により、2019年12月22日付で普通株式1株につき100株の割合で株式分割を行っており、第3期の期首に当該株式分割が行われたと仮定し、1株当たり純資産額及び1株当たり当期純利益又は1株当たり当期純損失(△)を算出しております。
3.潜在株式調整後1株当たり当期純利益については、第3期は潜在株式は存在するものの、当社株式は非上場であり、期中平均株価が把握できなく、1株当たり当期純損失であるため、また第4期は潜在株式は存在するものの、当社株式は非上場であり、期中平均株価が把握できないため記載しておりません。
4.自己資本利益率については、第3期は親会社株主に帰属する当期純損失であるため記載しておりません。
5.株価収益率については、当社株式は非上場であるため、記載しておりません。
6.第3期及び第4期の連結財務諸表については、「連結財務諸表の用語、様式及び作成方法に関する規則」(昭和51年大蔵省令第28号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、有限責任 あずさ監査法人の監査を受けております。
(2) 提出会社の経営指標等
(注)1.事業収益には、消費税等は含まれておりません。
2.当社は、B種優先株式について、2019年4月10日付で32,000株、2019年5月10日付で12,000株、2019年5月24日付で6,000株、合計して50,000株を有償第三者割当により増加しております。
3.当社は、2019年11月29日開催の取締役会決議により、2019年12月22日付で普通株式1株につき100株の割合で株式分割を行っており、第3期の期首に当該株式分割が行われたと仮定し、1株当たり純資産額及び1株当たり当期純利益又は1株当たり当期純損失(△)を算出しております。
4.潜在株式調整後1株当たり当期純利益については、第1期、第2期及び第3期は潜在株式は存在するものの、当社株式は非上場であり、期中平均株価が把握できなく、1株当たり当期純損失であるため、また第4期は潜在株式は存在するものの、当社株式は非上場であり、期中平均株価が把握できないため記載しておりません。
5.自己資本利益率については、第1期、第2期及び第3期は当期純損失であるため記載しておりません。
6.株価収益率については、当社株式は非上場であるため、記載しておりません。
7.1株当たり配当額及び配当性向については、配当を実施していないため記載しておりません。
8.主要な経営指標等の推移のうち、第1期及び第2期については、会社計算規則(平成18年法令省令13号)の規定に基づき算出した各数値を記載しており、金融商品取引法第193条の2第1項の規定による監査証明を受けておりません。
9.第3期及び第4期の財務諸表については、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、有限責任 あずさ監査法人の監査を受けております。
10.当社は、2019年12月10日付で、A種優先株主及びB種優先株主の株式取得優先権の行使を受けたことにより、全てのA種優先株式及びB種優先株式を自己株式として取得し、対価としてA種優先株主及びB種優先株主にA種優先株式及びB種優先株式1株につき普通株式1株を交付しております。また、2019年12月11日開催の取締役会決議により、当該A種優先株式及びB種優先株式の全てを消却しております。
11.2019年12月22日付で株式1株につき100株の株式分割を行っております。
そこで、東京証券取引所自主規制法人(現 日本取引所自主規制法人)の引受担当者宛通知「『新規上場申請のための有価証券報告書(Ⅰの部)』の作成上の留意点について」(平成24年8月21日付東証上審第133号)に基づき、第1期の期首に当該株式分割が行われたと仮定して算定した場合の1株当たり指標の推移を参考までに掲げると、以下のとおりとなります。
なお、第1期及び第2期の数値(1株当たり配当額については全ての数値)については、有限責任 あずさ監査法人の監査を受けておりません。
12.第1期の財務諸表については、2016年1月14日から2016年12月31日までであります。
2 【沿革】
3 【事業の内容】
当社グループ(以下、当社及び連結子会社Modalis Therapeutics Inc. (米国マサチューセッツ州ケンブリッジ市)の2社を指します。)は、コアとなるプラットフォーム技術である『切らないCRISPR技術※1(CRISPR-GNDM技術)』を用いた創薬によって、その多くが希少疾患に属する遺伝子疾患に対して治療薬を次々と生み出し、企業理念である「Every life deserves attention (すべての命に、光を)」のとおりに、病気のために希望を失わなくてすむ社会の実現に貢献してまいります。
当社グループのターゲットとしている遺伝子疾患とは、10,000(1)と言われるヒトの疾患の中で、約7,000(2)が患者数の少ない希少疾患(疾患のロングテール)と言われ、ほとんどはこの希少疾患に属します。これらの患者数は、一つ一つの疾患は細分化されていても、合わせると世界中で4億人(3)もいるとされています。希少疾患領域のための治療薬開発は、開発コストと開発期間が膨大にかかる従来型の創薬では効率が悪いためこれまで敬遠されており、95%(3) (5)の希少疾患にはまだ治療薬がありません。当社グループの技術力でこの問題解決に挑みます。
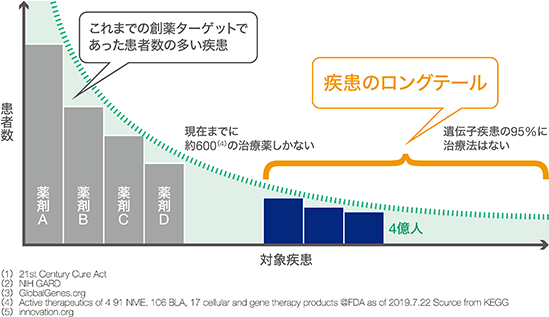
なお、当社のセグメントは遺伝子治療薬開発事業のみの単一セグメントであります。
(1) 当社の事業領域
当社は、遺伝子コード※2やエピジェネティクス※3のエラーによって生じる遺伝子疾患に対して、独自のプラットフォーム技術であるCRISPR-GNDM(Guide Nucleotide-Directed Modulation)技術を用いた遺伝子治療薬※4の開発を主たる事業としております。
① CRISPR-GNDM技術
CRISPR-GNDM技術とは、ゲノム編集技術であるCRISPR/Cas9※5のコア分子であるCas9というCRISPR酵素※6を基に、当社グループが開発した独自の創薬プラットフォームシステムです。
この技術は、Cas9タンパク質※7を詳細に解析して有効な改変を行い、また独自に開発した周辺技術と組み合わせ、目的遺伝子の発現(細胞内での出現量)をオン・オフすることを可能にしたものであり、いわば「遺伝子スイッチ」として機能するユニークかつパワフルな創薬技術(モダリティ)です。より具体的には、CRISPR酵素の切断活性※8を不活化し、これに遺伝子の転写※9を上げる、または下げるスイッチング分子※10を連結することにより、ガイド核酸※11で誘導された特定の箇所の近傍にある遺伝子を選択的にオン、またはオフにすることが可能になります。つまり、通常のゲノム編集とは異なり、遺伝子の切断を行わず効果を発現させる技術です。このCRISPR-GNDM技術によって、6,000を数えると言われる遺伝子疾患の原因遺伝子に対してエピジェネティクスを直接制御して治療法を生み出すことが可能になります。
<CRISPR-GNDM技術のイメージ図>
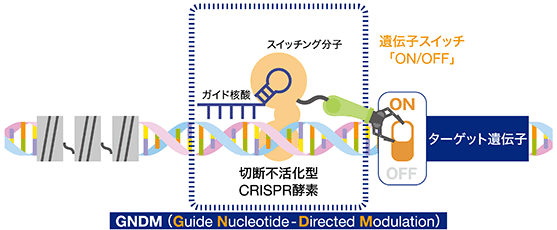
② CRISPR-GNDM技術の特徴
a. CRISPR-GNDM技術による成功確率の優位性
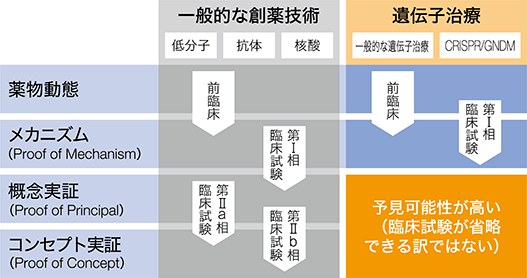
医薬品開発の主要な4つのハードルとして、薬物動態※12、メカニズム(Proof-of-Mechanism(PoM))※13、概念実証(Proof-of-Principal(PoP))※14、コンセプト実証(Proof-of-Concept(PoC))※15があります。
一般的な創薬技術(モダリティ)は、低分子医薬、抗体医薬、核酸医薬等があり、旧来の創薬である低分子医薬は、多くの候補の低分子化合物から目的の機能の評価試験法を用いて絞り込みをして開発候補物質を決め、開発のステージを進めていきますが、候補選択の評価試験法には限りがあり、着目している機能以外に毒性など不明なことが多いままに臨床試験を行うことになりますので、開発の各ステージで予期せぬ毒性などが露見し、次々とドロップアウトし、極めて少数のプロダクトが上市に辿り着くのが常でした。また近年は、病態や疾患の原因となるターゲット分子の同定※16が進んだことにもより、タンパク質や遺伝子のような標的に対して合理的にデザインされた分子によって治療を行おうとする、抗体医薬、核酸医薬等のように分子標的薬アプローチ※17が取られるようになりました。しかしながら、このようなアプローチをしても標的分子の種差によって候補物質の作用の仕方が動物とヒトの間に差がある場合があり、実際に実験してみるまでは薬効や毒性の程度の差はわからないという状況に変わりはありません。つまり、一般的な創薬技術においては、常にドロップアウトのリスクと隣り合わせであり、長期にわたり多額の研究開発投資を投入しても成功の予測が困難な状態が開発の最終段階までつきまといます。したがって、一般的な創薬技術であれば、第Ⅱ相臨床試験※18の終了まではその薬が効果を見せるかどうか、あるいは毒性があるかどうかは試験を実施するまで予見することが困難です。
一方で、当社のCRISPR-GNDM技術をはじめとして単因子遺伝子疾患※19を対象とする遺伝子治療薬開発においては、PoPとPoCの蓋然性がより高いと考えられます。多くの遺伝子治療でターゲットとする単因子遺伝子疾患においては原因が単一の遺伝子に起因しているため、PoP及びヒトPoC※20は予見可能性が高いと考えております。そのため、動物でターゲット遺伝子の正常化を行った結果が良好であれば、ヒトでの治療効果を早期に予見することができ、開発の成功確率が高まり、一般的なモダリティよりも早い段階でパートナー企業とのライセンス契約の締結に繋げることが可能と考えております。
<医療品開発の主要なハードル>
b. CRISPR-GNDM技術の移転可能性
一般的な創薬技術の場合は、ある一つの薬が臨床試験に成功して上市されたとしても、その開発ノウハウを別の薬に移転できる部分はあまり大きくありません。これは薬毎に性質が異なり、薬毎の利点も問題点も異なるからです。一般的な治療薬の開発は、数千〜数百万の化合物のライブラリーの中から薬効や薬物動態、毒性などを指標に適切な化合物の絞り込みを行い、さらに最適化を続けて開発に資する化合物へと何段階ものスクリーニングをしなければなりません。ターゲットの疾患毎にこうした作業はゼロから行うことになり、したがってある治療薬の開発経験やノウハウは他の治療薬へそのまま転用することが難しいと考えられます。
一方で、一般的な遺伝子治療薬開発においては必要な細胞への導入方法や製造方法の多くは、ターゲットの遺伝子が変わっても共通の部分が非常に多いと考えられているため、成功のノウハウと失敗の学びを他のターゲット遺伝子に対する遺伝子治療薬に転用することが一般的な創薬技術に比べて容易となると考えております。
CRISPR-GNDM技術においては、特に可変部分がガイド核酸(下記図中①)という非常に小さい部品に限られており、またその他の構成成分である切断不活型CRISPR酵素(下記図中②)とスイッチング分子(下記図中③)は共通のパーツとして既にあるため、標的疾患毎に対応したわずか約20塩基ほどのガイド核酸のみを個別にデザインをするだけで、効率よく遺伝子治療薬を開発することができると考えております。この技術的な特徴により、多くの遺伝子疾患にCRISPR-GNDM技術による創薬の方法論を拡張して遺伝子治療薬を生み出すことができると考えております。
<CRISPR-GNDM技術のコンセプト>

c. CRISPR-GNDM技術の収益の将来性
米国における遺伝子治療薬を開発するバイオテック企業の時価総額の累計は、『Human Gene Therapy Clinical Development Vol. 29, No. 4』(2018年12月、Mary Ann Liebert, Inc.発行)掲載の「Traditional Approaches for Company Valuation are Flawed for Valuing in vivo gene therapy companies」によると、2018年10月末時点において2,500億米ドル(約28兆円)に達し、特に2017年以降に急速な上昇を見せています。
その背景には、上記で述べた遺伝子治療薬開発においての予見可能であることによる成功確率の高さ及び他の遺伝子治療薬へノウハウを移転することの容易さという、2つの特徴によると考えられています。
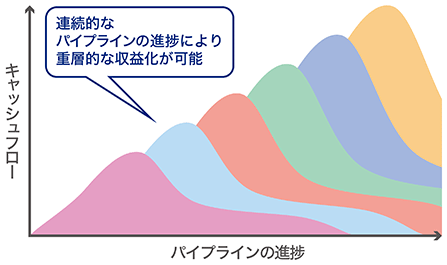
その結果、遺伝子治療薬開発において重層的なキャッシュ・フローを生み出すことが可能であると考えられており、遺伝子治療薬開発バイオテック企業の高い将来性の評価に繋がっていると考えております。特に、CRISPR-GNDM技術においては、一般的な遺伝子治療薬よりも他の疾患への技術移転が容易であるため、当社の収益性も高くなると考えております。
<遺伝子治療薬のキャッシュフローモデル>
d. CRISPR-GNDM技術の安全性
遺伝子治療の1つとしてゲノム編集治療があります。ゲノム編集は、染色体上の特定の場所にある遺伝子配列を部位特異的※21なヌクレアーゼ※22(切断酵素)を利用して、思い通りに改変する技術です。代表的な技術に第一世代のZFN(ジンクフィンガーヌクレアーゼ)※23、第二世代のTALEN(タレン)※24といった旧来からの技術に対して、第三世代となるCRISPRが新たに登場しました。CRISPRは旧来からの技術に対して、より簡便かつ高速にターゲットの遺伝子を改変することができると考えられています。これらの技術を用いたゲノム編集治療は、ヌクレアーゼを細胞内にウィルスベクター※25などを用いて送り込み、疾患の原因となった遺伝子コードやエピジェネティクスのエラーを書き換えて治療を試みるものです。
ターゲット遺伝子のカット&ペーストを行う通常のゲノム編集は、遺伝子コードのエラーによって生じる疾患に対して半/永続的に効果をもたらす有効な治療法ですが、遺伝子の二重鎖切断※26を伴うと、遺伝子を切断することでガン化リスクが高まることが報告されており、またそもそも狙った遺伝子ではなく他の遺伝子を切断するリスク等を伴う治療法であります。
一方で、遺伝子のエピジェネティクスの修復にフォーカスしたCRISPR-GNDM技術は、切断を含む遺伝子の配列の改変を行うことなく「遺伝子スイッチ」のオン・オフのみを制御するものであります。つまり、ターゲット遺伝子において異常な機能をもたらしている遺伝子の発現レベルを遺伝子によってはほぼゼロまで落とすことができ、あるいは発現量が足りないことによって疾患が生じている場合には発現量を高めて治療することができるという、遺伝子の切断を行う一般的なゲノム編集と比較して、遺伝子の切断を行わないCRISPR-GNDM技術はよりクリーンな方法で治療を行うことができると考えられています。
(2) 当社のビジネスモデル
① 当社のビジネスモデルの概要
創薬事業は、一般的に多額の研究開発費用と長い時間を要します。したがって、当社のように開発の初期段階を担う企業は、開発から上市までの収益の谷間を投資家からの資金と製薬企業等のパートナーからの契約金で賄っていく必要があります。
当社のビジネスモデルは、パートナーに技術プラットフォームであるCRISPR-GNDM技術を開放し、パートナーの選定したターゲットに対してパートナーの資金で治療薬の開発を行う「協業モデルパイプライン」と自社でCRISPR-GNDM技術を用いてターゲットの選定から行い、自己資金でCRISPR-GNDM技術を用いて治療薬の開発を行う「自社モデルパイプライン」の2種類があります。
当社は、協業モデルパイプラインと自社モデルパイプラインを組み合わせることによって、協業モデルの利点である早期の収益獲得と自社モデルの利点である将来の大きなアップサイドである上市後の収益獲得の両者の特徴を組み合わせた、「ハイブリッドモデル」を目指しております。これらを実現できる背景にあるのは、前項に述べたようにPoPとPoCの蓋然性の高さにあります。これにより、開発の早期から後期にいたるまであらゆるステージでパートナリングを行える可能性があり、協業モデルパイプラインと自社モデルパイプラインを組み合わせた連続的な創薬が実現できます。さらにハイブリッドモデルの強みは、このように幅広い収益機会に下支えされた資金を効果的に活用することで事業計画の選択肢が増え、その選択肢を最適化することで経営基盤の安定と成長領域への投資の双方を両立することを当社がコントロールできることにあります。

② 協業モデルパイプライン
当社の協業モデルパイプラインでは、最初に製薬企業等のパートナーとのターゲットの合意の基に共同研究開発契約を締結し、当社の技術プラットフォームであるCRISPR-GNDM技術を使用することに伴う共同研究開発の契約一時金(A)を受領します。共同研究開発契約後は、当社米国子会社においてパイプラインの開発を行い、その進捗に応じて共同研究開発のマイルストン収入(B)を受領します。プロトタイプ分子※27の作成、システムの最適化、動物モデルでの検証を経て、通常は前臨床試験の前の段階で将来の製造販売権の全てあるいは一部を譲渡するライセンス契約を締結し、ライセンスの契約一時金(C)を受領します。ライセンス契約締結後は、パートナーまたは共同で開発を行い、その開発の進捗に応じて当社はライセンスの開発マイルストン収入(D)を受領します。また、上市後は売上の一部からライセンスのロイヤルティ収入(E)及び一定の売上条件を達成した場合にライセンスのセールスマイルストン収入(F)を受領する予定です。ライセンス契約締結後のパイプラインの開発及び販売はパートナーに委ねられており、したがって、(D)、(E)及び(F)について当社でのコントロール及び売上予測は困難になるという特徴があります。
③ 自社モデルパイプライン
当社の自社モデルパイプラインでは、まずCRISPR-GNDM技術でターゲットにする疾患及び遺伝子の決定から始まります。これは、メカニズムに基づいて妥当と思われる遺伝子を絞り込み、その中でアンメットメディカルニーズ※28があるものを各疾患領域の専門家と綿密なディスカッションを通じて検証を行います。その後に当社技術を用いて、ターゲットに対して有効なプロトタイプ分子の作成を行います。さらにシステムの最適化を行いながら、疾患細胞、動物モデルなどを用いて実際に有効であるかどうかの検証を行います。この後に前臨床試験などによって毒性及び有効量の見積りを行い、GMP※29に準拠した原体の製造を行い、GLP※30準拠の前臨床試験を行うこととなります。
一般的には、当社が一定の開発段階まで開発を進めた後に、パートナーとのライセンス契約を行い、ライセンスの契約一時金(C)を受領する予定です。パートナーは、それ以降の開発及び販売を引き継ぐことになり、その開発の進捗に応じて当社はライセンスの開発マイルストン収入(D)、上市後は売上の一部からライセンスのロイヤルティ収入(E)及び一定の売上条件を達成した場合にライセンスのセールスマイルストン収入(F)を受領する予定です。
<当社のビジネスモデル>
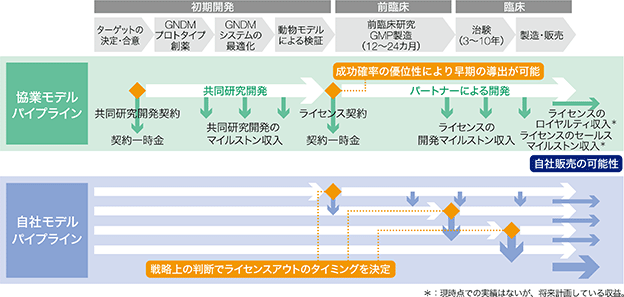
<当社の一般的な収入形態>
*:現時点での実績はないが、将来計画している収益。
当社の開発パイプラインは、パートナーと共同で開発する協業モデルパイプラインと自社で開発する自社モデルパイプラインにより構成されています。
2020年5月末現在において、5品目の協業モデルパイプラインと2品目の自社モデルパイプラインとを有しており、進捗状況は下記のとおりとなっております。
<当社の開発パイプライン(2020年5月末現在)>

パートナーとの共同研究契約に基づき開発してきたMDL-201及びMDL-202は、既にライセンス契約を締結しております。MDL-201及びMDL-202のライセンス契約では契約一時金及びマイルストンの合計で380億円以上の契約を締結しており、その他に上市後の売上に応じた販売ロイヤルティが設定されており、開発の進捗にしたがって当社は当該収益を段階的に獲得することになります。
当社は、この他にも共同研究開発契約に基づいた後続の協業モデルパイプラインを有しており、それらについても順次ライセンス契約を締結していく計画です。また、自社で開発する自社モデルパイプラインについても一定の段階でパートナーとライセンス契約を締結すべく取り組んでおります。
<用語解説>
4 【関係会社の状況】
(注) 1.「主要な事業の内容」欄には、セグメント情報に記載された名称を記載しております。
2.特定子会社に該当しません。
3.有価証券届出書又は有価証券報告書を提出している会社はありません。
5 【従業員の状況】
(1) 連結会社の状況
(注) 1.従業員数は就業人員(当社グループからグループ外への出向者を除き、グループ外から当社グループへの出向者を含む。)であり、臨時雇用者数(パートタイマー)は、最近1年間の平均人員(1日8時間換算)を( )外数で記載しております。
2.当社グループは、遺伝子治療薬開発事業の単一セグメントであるため、事業部門別の人数を記載しております。
3.全社(共通)と記載されている従業員数は、管理部門に所属している従業員であります。
(2) 提出会社の状況
(注) 1.従業員数は就業人員(当社から社外への出向者を除き、社外から当社への出向者を含む。)であり、臨時雇用者数(パートタイマー)は、最近1年間の平均人員(1日8時間換算)を( )外数で記載しております。
2.平均年間給与は、賞与及び基準外賃金を含んでおります。
3.当社グループは、遺伝子治療薬開発事業の単一セグメントであるため、事業部門別の人数を記載しております。
4.全社(共通)と記載されている従業員数は、管理部門に所属している従業員であります。
(3) 労働組合の状況
労働組合は結成されておりませんが、労使関係は円滑に推移しております。