第二部 【企業情報】
第1 【企業の概況】
1 【主要な経営指標等の推移】
(注) 1.当社は連結財務諸表を作成しておりませんので、連結会計年度に係る主要な経営指標等の推移については記載しておりません。
2.売上高には、消費税等は含まれておりません。
3.持分法を適用した場合の投資利益については、当社は関連会社を有していないため記載しておりません。
4.2019年12月10日開催の取締役会決議により、2019年12月27日付で普通株式1株につき700株の株式分割を行っており、発行済株式総数は4,867,100株となっております。
5.当社は配当を行っておりませんので、1株当たり配当額及び配当性向につきましては、それぞれ記載しておりません。
6.潜在株式調整後1株当たり当期純利益については、第16期、第17期及び第18期は新株予約権の残高がありますが、当社株式は非上場であり、期中平均株価が把握できないため、記載しておりません。また、第19期及び第20期は潜在株式が存在しないため記載しておりません。
7.当社株式は非上場であるため株価収益率は記載しておりません。
8.当社は、第19期よりキャッシュ・フロー計算書を作成しておりますので、第16期から第18期までのキャッシュ・フロー計算書に係る各項目については、記載しておりません。
9.従業員数は就業人員(当社から社外への出向者を除き、社外から当社への出向者を含む。)であり、臨時雇用者数(パートタイマー、人材会社からの派遣社員を含む。)は、年間の平均人員を〔 〕にて外数で記載しております。
10.第19期及び第20期の財務諸表については、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、有限責任 あずさ監査法人により監査を受けております。なお、第16期、第17期及び第18期の財務諸表については、「会社計算規則」(平成18年法務省令第13号)の規定に基づき算出した各数値を記載しております。また、当該各数値については、金融商品取引法第193条の2第1項の規定に基づく有限責任 あずさ監査法人の監査を受けておりません。
11.2019年12月10日開催の取締役会決議により、2019年12月27日付で普通株式1株につき700株の株式分割を行っておりますが、第19期の期首に当該株式分割が行われたと仮定し、1株当たり純資産額及び1株当たり当期純利益を算定しております。
12.当社は、2019年12月27日付で普通株式1株につき700株の株式分割を行っております。
そこで、東京証券取引所自主規制法人(現 日本取引所自主規制法人)の引受担当者宛通知「『新規上場申請のための有価証券報告書(Ⅰの部)』の作成上の留意点について」(平成24年8月21日付東証上審第133号)に基づき、第16期の期首に当該株式分割が行われたと仮定して算定した場合の1株当たり指標の推移を参考までに掲げると、以下のとおりとなります。
なお、第16期、第17期及び第18期の数値(1株当たり配当額につきましてはすべての数値)につきましては、有限責任 あずさ監査法人の監査を受けておりません。
2 【沿革】
(注1)「さい帯血」は、お母さんと赤ちゃんをつないでいる、へその緒や胎盤の中に含まれている赤ちゃんの血液であります。さい帯血には血液を造る「造血幹細胞」や、神経・軟骨・心筋細胞等さまざまな細胞に分化したり、各組織の修復に関与する「間葉系幹細胞」が含まれており、再生医療・細胞治療として、臨床研究が進められています。
(注2)ISO9001とは、製品の品質保証と顧客満足及び組織の管理・改善まで踏み込んだ品質マネジメントシステムの国際規格であります。
(注3)American Association of Blood Banksとは、輸血、細胞治療分野で、提供者及び患者の安全を守るため設立された国際非営利団体。全世界50カ国に認証施設があり、輸血等に関連する安全性の基準、認証の付与、認証調査、教育プログラムを実施しています。
3 【事業の内容】
当社は、民間さい帯血バンクとして1999年に設立され、「さい帯血」の分離・保管を行う「細胞バンク事業」を主な事業としております。なお、当社は「細胞バンク事業」の単一セグメントであるため、セグメント情報に関連付けた記載を行っていません。
(1)さい帯血バンクについて
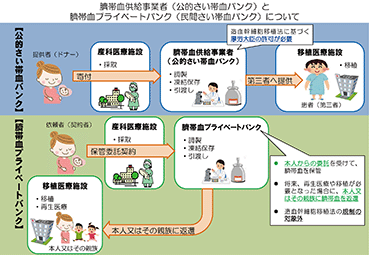
「さい帯血」は、お母さんと赤ちゃんをつないでいる、へその緒や胎盤の中に含まれている赤ちゃんの血液であります。さい帯血を保管する「さい帯血バンク」には、「公的さい帯血バンク」と「民間さい帯血バンク」があります。公的さい帯血バンクでは、造血幹細胞移植法に基づきお母さん達から「無償」でさい帯血の提供を受け、白血病等の病気で移植治療を必要とする患者さん(第三者)のために保管しております。2020年1月31日現在、厚生労働大臣の許可を受けた公的さい帯血バンクは全国に6ヵ所あります。
民間さい帯血バンクでは、「本人や家族」が、将来何らかの治療(主に脳性麻痺や自閉症等への再生医療)に
使うことができるようになる可能性を想定し、「有償」で、さい帯血の保管を行っております。
民間さい帯血バンクは、公的さい帯血バンクと違い許可制ではありませんが、厚生労働省(健康局)へ「臍帯
血取扱事業の届出」の提出を要請されており、同届出を行っている民間さい帯血バンクは2019年3月31日現在、
当社を含めて2社であり、当該2社のさい帯血保管総数は51,127件、当社の保管総数は50,406件(厚生労働省健
康局「臍帯血の引渡し実績等に関する報告」より。)となっております。
2020年1月31日現在、日本国内において、自己にさい帯血を投与(使用)するためには、対象疾患毎に、「再
生医療等の安全性の確保等に関する法律」(以下、「再生医療等安全性確保法」という)に基づき、「第2種再
生医療等(体性幹細胞など中リスクのもの)」として、臨床研究提供計画を「特定認定再生医療等委員会」
(注1)に提出し、審査を受け、承認された後、厚生労働大臣へ同提供計画を提出の上、実施する必要があり、
一般のクリニック等で自由に投与する事は認められておりません。
また、2020年1月31日現在、当社における顧客への再生医療等での利用目的(臨床研究における投与も含む)
の引渡件数は16件、研究(モデルマウス等での治療効果の検討)目的の引き渡し件数は74件となっております。
(出典:厚生労働省ホームページ(https://www.mhlw.go.jp/seisakunitsuite/
bunya/kenkou_iryou/kenkou/ishoku/saitaiketsu.html))
(2)当社の「細胞バンク事業」について
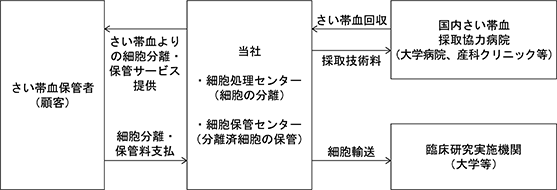
当社は、顧客(妊婦等)と「さい帯血分離保管委託契約」を締結した上で、国内さい帯血採取協力病院(大学病院、産科クリニック等)において採取されたさい帯血を回収し、自社の細胞処理センター(東京都港区)に搬入、さい帯血に含まれる幹細胞を分離・抽出・調製する作業を行った後、自社の細胞保管センター(神奈川県横浜市緑区)において、超低温下にて長期保管しております。「さい帯血分離保管委託契約」に基づき、顧客よりさい帯血にかかる分離料、検査料、登録料及び細胞保管料を収受し、将来の使用に備え、保管する事をビジネスモデルとしております。
さい帯血はその採取にあたっては、お母さん、赤ちゃんともに侵襲性が低く、また、通常は出産後に医療廃棄物として廃棄されるものである事から、倫理的にも扱いやすい点がメリットとして上げられます。一方、お産の状況によっては採取が困難である事、また、その採取量は同一ではなく、場合によっては十分な量が採取出来ない事が、デメリットとして上げられます。なお、さい帯血採取により、当社の定めた規定値以上の量を有し、保管基準を満たした場合に、国内さい帯血採取協力病院へ、採取技術料をお支払いしております。
体内の幹細胞は、幼児期には多く存在しておりますが、年齢を経るに従い減少して行くといわれております。さい帯血には血液を造る「造血幹細胞」や、神経・軟骨・心筋細胞等さまざまな細胞に分化したり、各組織の修復に関与する「間葉系幹細胞」が含まれており、遺伝子を導入して作成するようなものではなく、もともと自分の身体の中にある細胞(体性幹細胞)であるため、がん化のリスクも少なく、比較的安全に使用出来ることから、現在十分な治療法のない小児の中枢神経系疾患(低酸素性虚血性脳症:発症率1~3/1,000人:注2、脳性麻痺:同2~3/1,000人:注3)や自閉症スペクトラム障害(同1~2/100人:注4)等に対する「再生医療・細胞治療」として、臨床研究が進められております。
さい帯血は、血液疾患等の治療においては、「造血幹細胞移植法」、また、再生医療目的で使用する場合は、「再生医療等安全性確保法」に基づき、適正に使用される必要があります。これらの法律は専門的なものであることから、当社では、治療、検査目的等で当社において保管している細胞(さい帯血)の出庫が必要な場合は、外部有識者を含む専門の委員で組織している、社内倫理委員会において、審議を行いその妥当性を評価の上で実施しております。また、当社はさい帯血保管の品質向上を目的に、2011年よりISO9001の運用を開始しておりますが、グローバル基準への適合を目的に、2019年7月にさい帯血保管に関する国際基準AABBの認証を取得しております。なお、臨床研究実施機関への細胞輸送においても、AABBの品質管理基準を満たした輸送管理体制に基づき、実施しております。
当社は、2016年2月に再生医療等安全性確保法に基づき、特定細胞加工物製造許可を取得し、同法に基づく細胞提供の体制を整えております。
(ご参考)当社における保管(売上)検体数
※ 上表に記載の検体数は、厚生労働省への「臍帯血取扱事業の届出」記載の検体数より、売上に計上していない無料保管分を除いた検体数となっております。
(3)さい帯血を用いた国内の臨床研究の状況
さい帯血の臨床研究が進展していくことは、将来さい帯血がより広く利用できることを期待して保管されている当社顧客にとっても有益な情報であり、その動向は当社の業績に影響を与えるものであるとの観点から臨床研究の状況について記載します。
2017年1月に高知大学医学部附属病院で開始された「自家臍帯血を用いた小児脳性麻痺などの脳障害に対する臨床研究(第Ⅰ相)」では、当社の保管細胞が用いられ、2018年4月に予定投与数(6例目の最終投与)を終え、最終投与から約3年かけて患者の経過観察等を行ったうえで、安全性に係る評価が行われる見込みであります。
また、AMED(国立研究開発法人日本医療研究開発機構)の支援を受けながら、大阪市立大学医学部を中心としたグループが進めている、「低酸素性虚血性脳症(HIE)に対する自己臍帯血幹細胞治療」は、既に第Ⅰ相臨床研究(6例)が終了し、第Ⅱ相臨床研究が2019年12月に開始されております。
<日本で実施されている臨床研究(当社が細胞の処理・提供を行っているもの)>
※ 症例数は変更される可能性があります。また、各臨床研究は研究者の方針、診療結果により、延期・中止となる可
能性があります。
(4)細胞処理センターについて
再生医療等安全性確保法に基づき、厚生労働省(関東信越厚生局)より特定細胞加工物製造許可を受けた施設(東京都港区)で、さい帯血に含まれる幹細胞の分離・抽出・調製を行っております。またISO9001とAABBの認証を取得し、運営を行っております。
(5)細胞保管センターについて
新耐震基準に基づいた設計で耐震性を有している細胞保管施設です。細胞処理センターで分離・抽出・調製した幹細胞は、同施設内にある液体窒素タンクで保管し、その後、細胞保管センターに移送し長期保管用の大型の超低温液体窒素タンクで保管しております。
(注1)再生医療等技術や法律の専門家の有識者からなる合議制の委員会で、特に高度な審査能力、第三者性
を有するもので、一定の手続きにより厚生労働大臣の認定を受けたものをいいます。
(注2)「新生児低酸素性虚血性脳症で出生した重症仮死児への自己臍帯血幹細胞治療の研究」(新宅治夫)
より。
(注3)公益財団法人日本医療機能評価機構 産科医療補償制度運営委員会の「平成25年 産科医療補償制度
医学的調査専門委員会報告書」より。
(注4)厚生労働省の「e-ヘルスネット」(2019年11月末時点)より。
(注5)第Ⅰ相試験では、少数の被験者が参加し、安全性についての評価が行われております。
(注6)第Ⅰ相試験では、少数の被験者が参加し、安全性についての評価が行われております。
(注7)第Ⅱ相試験では、臨床探索的研究として実施される見込みで、さい帯血の処理及び供給体制などを検
討し、有効性と実施可能性を検証することを目的として行われる予定であります。
[事業系統図]
また、当社は細胞バンク事業の単一セグメントでありますが、売上高は「技術料」、「保管料」、「その他」の
3つから構成されております。
① 技術料
細胞分離の際に必要となる分離料、検査料及び登録料を技術料として分類しております。
② 保管料
細胞保管料を保管料として分類しております。保管料は年間の保管料を毎期収益として計上しております。
③ その他
主に契約更新時の更新手数料の他、分割払い手数料相当額をその他として分類しております。
4 【関係会社の状況】
(注)1.有価証券報告書の提出会社であります。
2.議決権の所有割合の( )は間接被所有で内数であります。
5 【従業員の状況】
(1) 提出会社の状況
(注) 1.従業員数は就業人員(当社から社外への出向者を除き、社外から当社への出向者を含む。)であり、臨時雇
用者数(パートタイマー、人材会社からの派遣社員を含む。)は、最近1年間の平均人員を( )外数で記載
しております。
2.平均年間給与は、賞与及び基準外賃金を含んでおります。
3.当社は細胞バンク事業の単一セグメントであるため、セグメントごとの記載はしておりません。
4.最近1年間において従業員数が22名、臨時雇用者数が25名それぞれ増加したのは、主として事業拡大に伴う新規採用によるものであります。
(2) 労働組合の状況
当社には労働組合は、結成されておりませんが、労使関係は良好に推移しております。