第二部 【企業情報】
第1 【企業の概況】
1 【主要な経営指標等の推移】
(注) 1.当社は連結財務諸表を作成しておりませんので、連結会計年度に係る主要な経営指標等の推移については記載しておりません。
2.売上高には、消費税等は含まれておりません。
3.持分法を適用した場合の投資利益については、関係会社を有していないため記載しておりません。
4.第17期の資本金の減少は、欠損補填を目的とする無償減資によるものであります。
5.2018年3月30日を払込期日とする第三者割当増資により普通株式119,510株を発行しております。
6.第15期及び第17期の潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、当社株式は非上場であるため、期中平均株価が把握できませんので、また、1株当たり当期純損失であるため記載しておりません。第16期の潜在株式調整後1株当たり当期純利益については、潜在株式は存在するものの、当社株式は非上場であるため、期中平均株価が把握できませんので、記載しておりません。第18期及び第19期の潜在株式調整後1株当たり当期純利益については、1株当たり当期純損失であり、また、潜在株式が存在しないため記載しておりません。
7.第15期、第17期、第18期及び第19期の自己資本利益率は、当期純損失であるため記載しておりません。
8.株価収益率については、当社株式は非上場であるため、記載しておりません。
9.1株当たり配当額及び配当性向については、無配のため、記載しておりません。
10.第15期、第16期及び第17期については、キャッシュ・フロー計算書を作成していないため、キャッシュ・フローに係る各項目については、記載しておりません。
11.主要な経営指標等の推移のうち、第15期、第16期及び第17期については、会社計算規則(平成18年法務省令第13号)の規定に基づき算出した各数値を記載しており、金融商品取引法第193条の2第1項の規定による監査証明を受けておりません。
12.第18期及び第19期の財務諸表については、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、有限責任 あずさ監査法人により監査を受けております。
13.2019年12月11日付で普通株式1株につき30株の割合で株式分割を行っております。第18期の期首に当該株式分割が行われたと仮定し、1株当たり純資産額及び1株当たり当期純損失を算定しております。
14.当社は、2019年12月11日付で普通株式1株につき30株の株式分割を行っております。
そこで、東京証券取引所自主規制法人(現 日本取引所自主規制法人)の引受担当者宛通知「『新規上場申請のための有価証券報告書(Ⅰの部)』の作成上の留意点について」(平成24年8月21日付東証上審第133号)に基づき、第15期の期首に当該株式分割が行われたと仮定して算出した場合の1株当たり指標の推移を参考までに掲げると、以下のとおりとなります。
なお、第15期、第16期及び第17期の数値(1株当たり配当額についてはすべての数値)については、有限責任 あずさ監査法人の監査を受けておりません。
2 【沿革】
当社は、2001年2月に東京大学先端科学技術研究センター・システム生物医学ラボラトリー(LSBM)で開発された蛋白質発現・抗体(注1)作製技術を基盤として、診断・創薬標的に対応する抗体の医療への活用を目指して設立されました。
(注)1.抗体:抗原(免疫反応を引き起こす物質)の構造に応じて1対1の関係で特異的に結合する蛋白質。この特異的な結合力を利用して、がんや感染症、疾患を診断・治療する医薬品(分子標的薬)に応用されます。
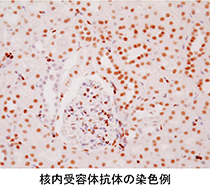
2.核内受容体抗体:ヒトでは48種類存在する核内受容体それぞれに特異的に結合する抗体。核内受容体は、脂溶性シグナル伝達分子と結合し、核内でDNAの転写の活性化あるいは抑制を起こします。
3.タンパク質相互作用解析ナノバイオチッププロジェクト:国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO)による、機能を保持した状態での蛋白質発現及び蛋白質相互作用解析に係る技術開発を行うプロジェクト。
4.グリピカン3:グリコシルホスファチジルイノシトール(GPI)アンカーと呼ばれる蛋白質を細胞表面に繋ぎとめる錨の役割をする糖脂質を介して細胞膜表面に結合するヘパラン硫酸プロテオグリカン。肝臓がんで高発現する事が見いだされています。
5.PTX3:Pentraxin3の略。体内の炎症により産生される炎症性蛋白質の一つ。
ELISA:Enzyme Linked ImmunoSorbent Assayの略。抗原抗体反応を利用し、酵素反応に基づく発光、発色をシグナルとして検出する事で特定の物質の濃度を計測する方法。
6.放射性同位体(RI)標識抗体:放射性同位体(RI)を連結した抗体。抗体は連結したRIの種類により診断や治療に用いる事が出来ます。
7.導出:特定の医薬品を開発、販売するために必要な知的財産権の使用を許可すること。
8.トランスフェリン受容体:トランスフェリン受容体は、細胞膜上に存在し、細胞内への鉄取り込みに関与します。
9.T細胞:リンパ球の一種で、骨髄で産生された前駆細胞が胸腺での選択を経て分化成熟したもの。 細胞表面に特徴的なT細胞受容体(T cell receptor:TCR)を有しています。
10.研究成果最適展開支援プログラム(A-STEP):国立研究開発法人科学技術振興機構(JST)による、大学・公的研究機関等で生まれた国民経済上重要な科学技術に関する研究成果を基にした実用化を目指す研究開発フェーズを対象とした技術移転支援プログラム。
3 【事業の内容】
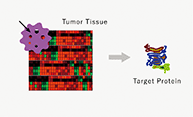
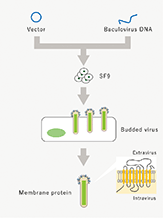
当社は東京大学先端科学技術研究センター・システム生物医学ラボラトリー(LSBM)で開発された蛋白質発現・抗体作製技術を基盤として、診断・創薬標的に対応する抗体の医療への活用を目指して設立されました。創業以来、医薬品シーズ(※1)抗体を創生する事で、がん及びその他疾患の治療用医薬品の研究開発、及び関連業務を行っております。LSBMで開発された蛋白質発現技術は、従来調製が困難であった膜蛋白質を効率的に発現し、これを動物免疫法と組み合わせる事で、親和性(※2)の高い抗体の効率的な取得を可能にしています。更に当社は多様性に富むファージ抗体ライブラリ(※3)と特許技術でもある独自の抗体スクリーニング(※4)技術を保有しており、これらを対象とする疾患の細胞に適用する事で、創薬標的の探索、及び従来の動物免疫法で得られるものとは異なる特徴を持つ高機能シーズ抗体の同時取得を可能にしています。当社の技術は、これら二つの抗体技術とシーズ探索術を融合し、医療ニーズにマッチした医薬品シーズ抗体を取得することを特長としております。また、当社は東京大学発である事を起点として、さらにそのネットワークを広げ、多くのアカデミアとの連携により最新のサイエンスのもとで創薬を行うことを使命としております。
抗体医薬品(※5)は、近年副作用の少ない画期的な治療薬として脚光を浴び、現在低分子医薬を抜いて抗がん剤の主流となっています。2018年度の世界の医薬品売上高上位10位のうち6品目が抗がん剤で、そのうち5品目が抗体医薬品であります。しかしながら、がんは極めて巧妙なメカニズムにより、治療から逃れていこうとしており、抗体医薬品ですら未だ満足できるものは完成しているとは言えません。また、近年免疫チェックポイント阻害抗体(※6)やADC(Antibody Drug Conjugate)(※7)等の抗体医薬品の新しい潮流は見えてきておりますが、奏効率、副作用の観点から未だ満足できるものではなく、未だ新規抗体医薬品の開発が望まれております。なお、がん以外も含めた抗体医薬品では、医薬品売上高上位10位のうち6品目を占め、抗体医薬品の重要性がますます増してきています。(出典:日経バイオテク 世界の医薬品ランキング2018年度)このような事業環境の中で、当社は機能性の高い抗体を、当社独自の技術で作製し、その抗体を治療薬として開発し、また、治療薬として開発した抗体にRIや毒素を化学的に結合させることでがん細胞への攻撃力を高めるような研究開発も行っております。
<シーズ探索のアプローチ>
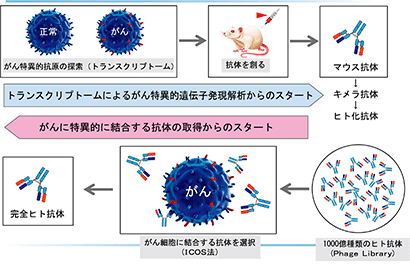
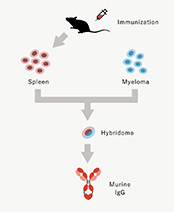
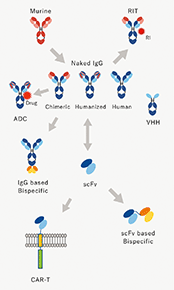
(注)マウス抗体:マウスに免疫して得られた抗体。
キメラ抗体:遺伝子工学的手法によりマウス抗体の可変領域とヒト抗体の定常領域を連結したもの。
ヒト化抗体:遺伝子工学を用いてマウスで作成した抗体の抗原結合部位をヒト由来の抗体分子に移植して作製された抗体分子。配列的にキメラ抗体より更にヒト抗体に近い。
完全ヒト抗体:蛋白質配列が全てヒト遺伝子に由来する抗体。他の生物種由来の配列を含まないため、より安全性が高いと考えられています。
(1) 当社の技術
① 抗体探索
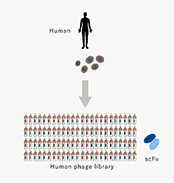
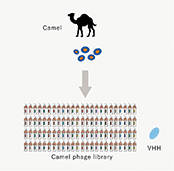
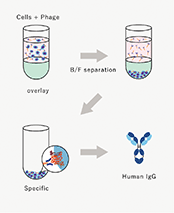
a.ファージディスプレイ法
動物を用いずに、抗体ライブラリから特定の標的分子との結合抗体配列(※8)を濃縮・選別します。当社は、保有する抗体ライブラリと独自のスクリーニング技法を組み合わせる事で、機能性に優れた抗体を取得しています。
(2) 事業の特徴
当社の事業セグメントは、医薬品事業のみの単一セグメントでありますが、以下の各分野における製品化に向けた研究開発、ライセンス、製造方法の確立に取り組んでおります。
① 創薬
当社は、長年の経験に基づいた動物免疫法と、独自のスクリーニング技法を取り入れたファージディスプレイ法により、高機能抗体を取得したうえで、抗体に遺伝子工学的な改変あるいは化学的な修飾を施し、抗体医薬品候補としての研究開発を進めております。
当社は、これまでに創出したがん治療用抗体のうち、肝臓がんを標的とする抗体及び固形がんを標的とするRI標識抗体を、それぞれ製薬メーカーである中外製薬株式会社及び富士フイルム株式会社に導出し、現在、導出先により臨床試験が行われております。また、難治性血液がんを標的とした抗体は2014年に国立研究開発法人科学技術振興機構(JST)の研究成果最適展開支援プログラム(A-STEP)に採択され開発を進め、2018年より企業主体の開発に切り替えて推進中です。さらに、難治性固形がんを標的とした薬物結合抗体(ADC)等数々のがん治療用抗体の研究・開発を進めております。
なお、当社における抗体創薬の特長は、医薬品として高い薬理効果が期待できる新規抗体を効率的に取得することです。この抗体の物質特許が事業のベースになり、その抗体を医薬品として患者さんに届けるべく非臨床試験、臨床試験及び薬事承認を得るまで如何に早く進めるかが課題となります。導出については、一般的に、特許取得後すぐに大手製薬に導出する場合、自社で非臨床試験を完了してから導出する場合、自社であるいはパートナー企業と共同で臨床試験を実施し、パイプラインの価値を高めてから製薬企業に導出する場合などがあります。この導出の形態は、薬剤の特性、薬剤ごとに異なる臨床試験の計画、適応疾患及び開発費用等を勘案して決定いたします。
近年、抗体医薬品の認知が高まり多数の抗体医薬品が上市(※23)され、抗体医薬品ビジネスの競争も激化しつつあります。これに伴い非臨床段階では有利な経済条件で導出することが難しくなりつつあります。当社は、抗体医薬品を早期に患者様に届けるため自社でも積極的に臨床試験を実施し、製薬企業に導出していくことを推進してまいります。
本書提出日現在においては、導出済みの3抗体に続く薬剤候補である抗トランスフェリン受容体抗体の開発に集中するとともに、新規抗体のシーズ探索を行っております。新規抗体に関しては、当社の保有する「がん特異的抗体ライブラリ」を探索した結果、複数の候補が見つかっております。また、新規標識技術との組合せによるADC化などのFeasibility研究(※24)も進んでおります。
なお、各開発品の詳細については、後述「(3) 当社の開発品」をご参照ください。
② 抗体研究支援
当社は、これまでにがん等を対象とした抗体医薬品や研究用試薬の創出を通じて培ってきた技術や経験を活かして、抗体に関連した研究支援(研究受託)を実施しております。特にアカデミアや製薬企業に対する抗体研究支援は、当社の創薬活動とのシナジー効果が期待されます。
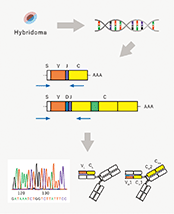
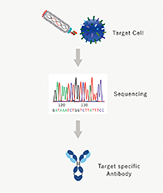
a.マウス ハイブリドーマから抗体可変領域のアミノ酸配列の解読サービス
凍結ハイブリドーマを受領し、mRNA(※25)抽出後、cDNA(※26)合成したうえで、当社独自のプライマーによる可変領域の遺伝子を増幅いたします。クローニング(※27)後、遺伝子配列を解析し、解析配列の報告書(H鎖とL鎖の可変領域の遺伝子配列及び、アミノ酸配列、CDR配列(※28))を提出しております。
b.組み換え抗体作製
HEK細胞(※29)の一過性発現系を利用し、主としてIgG抗体を迅速に生産します。抗体創薬開発における、探索から非臨床試験へ移行する途上でマウス薬効試験に必要となるエンドトキシンフリー(※30)の数~数十㎎程度のIgGを合成・精製して、薬効確認試験の支援が可能です。発現Plasmid(※31)への組み込みやIgGクラス変換、Isotype Control抗体(※32)の提供、担がん薬効試験代行(薬効モデル構築支援・投与・割付・統計解析)のサービスも行います。
c.研究受託
抗体の作製、物性解析、薬効薬理評価を実施しております。
③ 抗体・試薬販売
当社では、がんや生活習慣病など各種疾患のバイオマーカーとなる核内受容体抗体を全48種類取り揃えており、世界の研究者に向けて研究用試薬として販売しております。また、Pentraxin3(PTX3/TSG-14)のELISAキットの開発に成功し、研究用試薬として販売しております。
(3) 当社の開発品
当社の開発パイプラインの進捗状況は以下のとおりです。
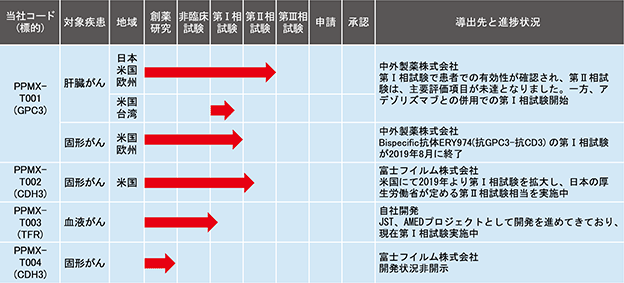
① PPMX-T001
中外製薬株式会社 開発コード等
「GC33」(RG7686)抗グリピカン3ヒト化モノクローナル抗体 一般名:codrituzumab
「ERY974」抗グリピカン3/CD3バイスペシフィック抗体
a.特徴
PPMX-T001は、遺伝子チップを用いたトランスクリプトーム解析により見出された肝臓がんで特異的に発現が高いグリピカン3(GPC3)を標的としております。
東京大学先端科学技術研究センターの油谷浩幸教授を中心とするグループでは、DNAマイクロアレイ(※39)を用いたRNAの網羅的解析であるトランスクリプトーム解析を系統的に実施しております。この解析から、肝臓がん組織と正常組織の比較からがんに特異的に発現する遺伝子を捉えることに成功しております。その中の1つの分子がGPC3であり、GPC3は、細胞膜表面上に存在する約60kDaの糖蛋白質で、グリコシルフォスファチジルイノシトール(GPI)アンカーにより細胞膜に結合しています。トランスクリプトーム解析から、GPC3遺伝子が胎児期の肝臓と肝がん細胞において高発現していることが確認されました。エピトープの異なる複数の抗体を用いて、各種病理標本で組織染色を行った結果、GPC3は肝がん組織に発現している一方で、成人正常肝臓、肝炎及び肝硬変の組織には発現が認められなかったことから、肝臓がん治療薬としての可能性を見出しました。この技術を譲り受けた中外製薬株式会社が独自に取得した抗体を治療薬として開発しております。
b.開発状況
この開発中の治療薬は、第Ⅰ相試験で患者での有効性が確認され、第Ⅱ相試験は、主要評価項目が未達となりました。一方、アデゾリズマブとの併用で第Ⅰ相試験を行い、患者での有効性が確認されたことが学会発表されております。更に2016年にBispecific抗体(※40)ERY974(抗GPC3-抗CD3)の第Ⅰ相試験が開始され、2019年8月に終了しております。
c.対象疾患
肝臓がん
d.ライセンスの状況
2006年9月に、肝臓がんを適応として、中外製薬株式会社との間に抗GPC3抗体の特許を受ける権利等の譲渡に関する契約を締結しました。 本契約には、開発の全部を中止する場合は、事前に中外製薬株式会社から通知を受けることになっておりますが、その他の情報の入手については、規定されておらず、限定的になる可能性があります。
なお、当該契約の契約期間は、当該特許の存続期間満了日迄であり、この契約で定めている特許は、次のとおりです。
権利者:中外製薬株式会社
出願番号:PCT/JP2002/006237
② PPMX-T002
富士フイルム株式会社 開発コード:FF-21101
a.特徴
PPMX-T002は、がん細胞表面に存在するカドヘリン3(CDH3)を標的とした開発中の治療薬です。カドヘリン3は、細胞間接着蛋白質として機能すると考えられています。トランスクリプトーム解析から、主要正常臓器において発現が低く、各種がんで多く発現している標的として見出されました。
PPMX-T002は、放射性同位体(RI)を標識した抗体(Armed抗体(※41))を用いた抗がん剤で、通常の抗体医薬品とは異なる作用メカニズムを持ちます。一般的な抗体医薬品は、抗体ががん細胞表面に発現する特定の蛋白質に結合し、生体が持つ免疫機能を誘引することで標的細胞を攻撃しますが、免疫機能が低下した患者に対しては効果が弱くなります。一方PPMX-T002は、動物免疫で取得し、遺伝子改変した抗体にRIを標識し、がん細胞に集積させ、RIから放出する放射線で直接がん細胞を攻撃することができるため、患者の免疫機能の状態に関わらず、高い効果が期待できます。また、PPMX-T002は、固形がんの細胞表面に多く発現しているCDH3を標的とし、肺がんや膵臓がんなどの細胞に高い集積性を有する抗体を用いています。
b.開発状況
富士フイルム株式会社が米国にて2016年より進行性固形がん患者に対する抗がん剤として、第Ⅰ相試験を開始し、投与された患者でPPMX-T002の抗体が、がん組織に集積すること、及び安全性が確認された用量で一部症例において腫瘍の縮小が確認されました。2019年より第Ⅰ相試験を拡大し、最大耐容用量で症例数を増やし、日本の厚生労働省の定める第Ⅱ相試験相当を実施中です。なお、国内での第Ⅰ相試験も検討中との説明を受けております。
c.対象疾患
CDH3陽性難治性固形がん(卵巣がん、胆道がん、頭頸部扁平上皮がん)
d.ライセンスの状況
2011年1月に、当社及び富士フイルムRIファーマ株式会社(現 富士フイルム富山化学株式会社)のPPMX-T002に関する権利(「研究・開発」及び「製造・販売」等)を富士フイルム株式会社に実施許諾する契約を締結しました。
③ PPMX-T003
a.特徴
PPMX-T003は、トランスフェリン受容体(TFR)を標的とします。TFRは、鉄を結合したトランスフェリンを細胞内に取り込むため、細胞膜上に発現しています。細胞の生存には細胞内への鉄イオン取り込みが必須であり、多くのがん細胞でTFRが高発現していることが広く知られています。鉄イオン取り込みの阻害は細胞内の鉄イオンを枯渇させ、細胞死を引き起こします。ファージディスプレイ法で極めて高い鉄取り込み阻害能を示す完全ヒト抗体を取得し、各種疾患に対する臨床試験を準備しています。
PPMX-T003は、当社独自技術ICOS法により取得したユニークなヒト抗体であり、TFRに結合することでがん細胞の鉄の取り込みを阻害し、強力な抗腫瘍効果を示しております。これにより、化学療法剤で生じるような患者の大幅なQOL(※42)低下を伴わない治療効果が期待されます。また、試験管内で幅広い種類の血液がんに抗腫瘍効果を発揮し、各種マウスモデルでがん縮小/延命効果を発揮いたしました。
b.開発状況
国立研究開発法人科学技術振興機構(JST)研究開発成果最適展開支援プログラムの支援を得て、2018年にサルを用いた非臨床毒性試験を完了しております。2015年に終了した毒性予備試験と同様の結果を得て、開発が前進いたしました。また、今回の毒性試験の完了をもって研究開発成果最適展開プログラムは終了し、今後当社自己資金により、開発を継続し企業治験を実施して行くことになりました。
前事業年度に治験薬製造を開始し、当事業年度にPV(真性多血症)治療薬としての第Ⅰ相試験を開始しました。併せて、急性骨髄性白血病、悪性リンパ腫等の血液がん治療薬としての作用機構を明確化するため、宮崎大学、名古屋大学、藤田医科大学、順天堂大学等と共同で臨床効果に関する創薬研究を推進しております。
c.対象疾患
血液がん
d.ライセンスの状況
本書提出日現在、日本及びグローバルでのライセンスの提携先は決まっておりません。
④ PPMX-T004
a.特徴
PPMX-T004は、がん細胞表面に存在するカドヘリン3(CDH3)を標的とした開発中の治療薬です。CDH3は、細胞間接着蛋白質として機能すると考えられています。
PPMX-T004は、遺伝子改変した抗体に薬物を標識した抗体薬剤複合体で、これと結合したがん細胞を標識した薬物で殺傷することができるため、患者の免疫機能の状態に関わらず、高い効果が期待できます。PPMX-T004では、固形がんの細胞表面に多く発現しているCDH3を標的とし、がんの細胞に対し高い内在性を有する抗体を用いています。
b.開発状況
導出先との契約により開発状況は開示できません。
c.対象疾患
CDH3を発現する固形がん
d.ライセンスの状況
富士フイルム株式会社に導出済みです。
⑤ その他
当社は患者組織を利用することで取得した疾患特異的な標的候補を多数保有しております。これら標的群に対する抗体取得を順次進めており、Naked、ARMEDなど多様なプラットフォームを用いた自社開発プログラムを推進中です。
<事業系統図>
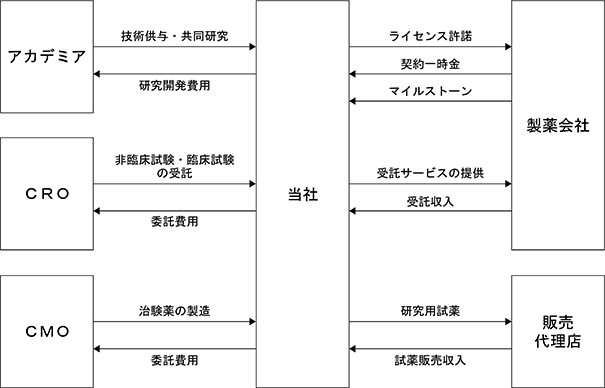
(注)CRO:Contract Research Organization(開発業務受託機関)の略。企業、医療機関、行政機関等の依頼により、医薬品、医療機器、食品(特定保健用健康食品)、化粧品等の臨床開発及び臨床試験(治験)に関わる業務を、受託、又は労働者派遣等で支援する機関のこと。依頼企業は、専門性の高い人材を活用できるため、開発から承認までの時間を効率化できるメリットがあります。
CMO:Contract Manufacturing Organization(医薬品製造受託機関)の略。製薬メーカーから医薬品(治験薬・市販薬を含む)の製造を受託します。
<用語集>
4 【関係会社の状況】
関係会社は次のとおりであります。
5 【従業員の状況】
(1) 提出会社の状況
当社は、医薬品事業の単一セグメントであるため、事業部門別に記載しております。
(注) 1.従業員数は就業人員(社外から当社への出向者を含む。)であります。
2.従業員数欄の(外書)は、臨時従業員の年間平均雇用人員であります。
3.平均年間給与は、基準外賃金を含んでおります。
(2) 労働組合の状況
当社の労働組合は、結成されておりませんが、労使関係は円満に推移しております。