第二部 【企業情報】
第1 【企業の概況】
1 【主要な経営指標等の推移】
(注) 1.当社は連結財務諸表を作成しておりませんので、連結会計年度に係る主要な経営指標等の推移については記載しておりません。
2.売上高には、消費税等は含まれておりません。
3.持分法を適用した場合の投資利益については、関連会社がないため記載しておりません。
4.1株当たり配当額及び配当性向については、配当を実施していないため記載しておりません。
5.第1期においては潜在株式が存在しないため、潜在株式調整後1株当たり当期純利益については記載しておりません。第2期及び第3期については、新株予約権の残高がありますが、当社株式は非上場であり、期中平均株価が把握できないため、潜在株式調整後1株当たり当期純利益については記載しておりません。
6.株価収益率は当社株式が非上場であるため記載しておりません。
7.従業員数欄の[ ]には、臨時雇用者(パートタイマー及び派遣社員)の年間平均雇用人員(月末平均)を外数で記載しております。
8.主要な経営指標等のうち、第1期については会社計算規則(平成18年法務省令第13号)の規定に基づき算出した各数値を記載しており、金融商品取引法第193条の2第1項の規定による監査証明を受けておりません。
9.前事業年度(第2期)及び当事業年度(第3期)の財務諸表については、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59条)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、EY新日本有限責任監査法人により監査を受けております。
10.第1期についてはキャッシュ・フロー計算書を作成しておりませんので、キャッシュ・フローに係る各項目については記載しておりません。
11.当社は、2016年12月1日付及び2018年5月10日付でそれぞれ普通株式1株につき2株の株式分割を、また2019年4月1日付で普通株式1株につき200株の株式分割を行っておりますが、第2期の期首に当該株式分割が行われたと仮定し、1株当たり純資産額及び1株当たり当期純利益を算定しております。
12.当社は、2016年12月1日付及び2018年5月10日付でそれぞれ普通株式1株につき2株の株式分割を、また2019年4月1日付で普通株式1株につき200株の株式分割を行っております。そこで、東京証券取引所自主規制法人の引受担当者宛通知「『新規上場申請のための有価証券報告書(Ⅰの部)』の作成上の留意点について」(2012年8月21日付東証上審第133号)に基づき、第1期の期首に当該株式分割が行われたと仮定して算定した場合の1株当たり指標の推移を参考までに掲げると以下のとおりとなります。
なお、第1期の数値(1株当たり配当額についてはすべての数値)についてはEY新日本有限責任監査法人の監査を受けておりません。
2 【沿革】
当社の創業者である山川雅之氏(医師。現当社大株主。元当社代表取締役)及び裙本理人(当社代表取締役社長)は、再生医療の産業化推進を目的として、2015年11月に東京都港区西麻布において当社を創業いたしました。
当社設立以降の主な沿革は、次のとおりであります。
3 【事業の内容】
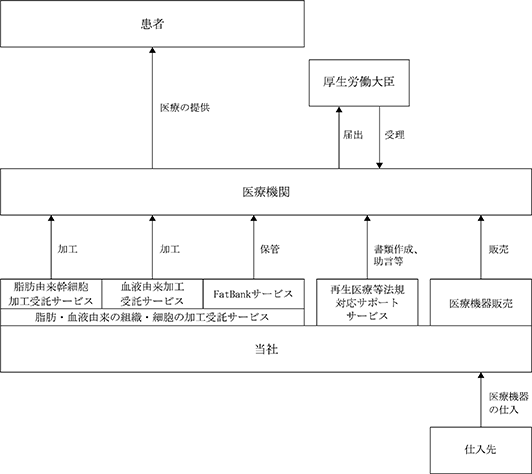
当社は、再生医療(※)を提供する医療機関への「脂肪・血液由来の組織・細胞の加工受託サービス」、再生医療等の安全性の確保等に関する法律(以下、「再生医療等安全性確保法」)に関する「再生医療等法規対応サポートサービス」、及び「医療機器販売」で構成される「再生医療関連事業」と、化粧品及び美顔器を一般消費者に販売する「コンシューマー事業」に取り組んでおります。
各事業の内容及び特徴は次のとおりであります。なお、これらの事業は、「第5 経理の状況 1 財務諸表等 (1) 財務諸表 注記事項」におけるセグメントの区分と同一であります。
(※) 本書において「再生医療」は、「再生医療等安全性確保法」第2条第1項に定める「再生医療等」と同一の定義で使用しております。また、本書において「再生医療等」とは、かかる再生医療に加え、当社が提供する「血液由来加工受託サービス」や「FatBankサービス」を利用した治療など再生医療等安全性確保法の対象外の治療を含むものとしています。
(1) 再生医療関連事業
① 脂肪・血液由来の組織・細胞の加工受託サービス
a.脂肪由来幹細胞加工受託サービス
2014年11月に施行された「再生医療等安全性確保法」では、医療機関が、再生医療に用いる細胞の加工作業を特定細胞加工物製造許可を取得した加工施設を有する外部企業へ委託することが認められております。
当社の再生医療センターは同法に基づく当該製造許可を取得しており、整形外科や形成外科等の医療機関より委託を受けて、当該医療機関が患者から採取する脂肪組織を預かり、脂肪組織由来間葉系幹細胞(以下、「脂肪由来幹細胞」(※))を抽出、培養、凍結保存する加工作業を行っております。なお、本サービスの委託者である医療機関は、患者から採取した脂肪組織から加工された 脂肪由来幹細胞を公的医療保険が適用されない自由診療(以下、「自由診療」)のもとで、当該患者に対して主に変形性膝関節症の治療に用いております。
当社の行う脂肪由来幹細胞の加工作業に必要な脂肪組織は約20mlと少量であり、抽出及び培養後は凍結処理により長期保存が可能であります。したがって、医療機関は本サービスを当社に委託することにより、少量の脂肪組織の採取で当該患者に対して複数回の脂肪由来幹細胞の患部への投与が可能となるため、医療機関及び患者の負担が軽減されます。
本サービスでは、患者から採取された脂肪組織の加工作業が完了した時点で加工受託に係る会計上の収益を計上し、その後、当該加工の委託者である医療機関からの要請による脂肪由来幹細胞の発送の都度、配送並びに凍結保存の対価として手数料を収受し、別途配送料として会計上の収益を計上しております。
(※) 「脂肪由来幹細胞」とは、脂肪、骨、筋肉、血管等の様々な組織への分化能を有する幹細胞であり、主に創傷治癒・抗炎症性免疫調節・新生血管形成等の働きがあると言われております。この作用を利用し、患部等に脂肪由来幹細胞を注入することで炎症の抑制や硬化した組織の再生等の様々な効果が期待されています。また、医療業界での最近の研究から、これら作用・効果の機序として、幹細胞自身の直接作用のみでなく、幹細胞が産生する細胞外小胞(以下、「エクソソーム」)による周囲の細胞へのパラクライン効果(分泌物による近隣の細胞や組織への作用効果)が着目されています。
b.血液由来加工受託サービス
本サービスにおいて当社は、整形外科や形成外科等の医療機関より委託を受けて、当該医療機関が患者から採取する血液を預かり、その血液から多血小板血漿(PRP)(※1)を作成し、活性化させ、成長因子等を濃縮し、無細胞化した後に凍結乾燥(フリーズドライ)を施した「PFC-FD」(※2)を作成する加工作業を行っております。なお、本サービスの委託者である医療機関は、当該患者に対する自由診療における主に変形性膝関節症などの治療を目的として、「PFC-FD」を用いております。
現在、自己血から抽出したPRPを患部に注入し自己組織の修復を促す治療が整形外科、形成外科、皮膚科等で行われておりますが、本サービスにおいて、特許取得済みの当社独自技術により加工作成される「PFC-FD」は、医療機関内にて常温かつ長期間での保存が可能である点が特徴であります。
本サービスでは、加工の成果物であるPFC-FDを、委託者である医療機関に一括して発送しており、本サービスによる会計上の収益はPFC-FDの発送時点で計上しております。
(※1)「多血小板血漿(PRP)」とは、血小板が多く含まれる血漿の事であります。血液中の血小板は様々な成長因子を含有し、組織の治癒過程において細胞の働きを調整する機能を有しております。この作用を利用し、患部等にPRPを注入することで炎症を抑制させる等の効果が期待されております。
(※2)「PFC-FD」を用いた療法は、サイトカイン(細胞から分泌される低分子のタンパク質である生理活性物質)のみを投与する療法となります。そのため、細胞加工物であるPRP療法とは異なり再生医療等安全性確保法の対象外となります。
c.FatBankサービス
本サービスにおいて当社は、形成外科や美容外科等の医療機関より委託を受けて、医療機関が形成医療や美容医療等を目的として採取した患者の脂肪組織を預かり、脂肪組織を劣化させない超低温の環境で長期間の保管を行っております。従来、医療機関が脂肪組織を利用する医療を提供する際には、患者から都度、脂肪組織を採取しておりましたが、医療機関は本サービスを利用することで、必要な脂肪組織を安全に長期間保管しておくことができるようになります。そのため、医療提供時に患者から都度、脂肪組織を採取する必要がなくなり、医療機関及び患者の負担が軽減されます。
本サービスでは、会計上、脂肪組織の凍結保存処理が完了した時点で当該処理に係る収益、並びに医療機関の要請により保管している脂肪組織の配送時点で当該配送料に係る収益を計上しております。なお、当社は、1年を超える保管を行う場合には、追加で保管延長料に係る収益を計上します。
② 再生医療等法規対応サポートサービス
医療機関が患者に再生医療を提供する場合、「再生医療等安全性確保法」に基づき、提供しようとする再生医療のリスクに応じた提供計画を事前に厚生労働大臣に提出することが義務づけられており、また、医療機関が自院で脂肪由来幹細胞や多血小板血漿(PRP)などの特定細胞加工物を製造する場合は、事前に厚生労働大臣へ届出することが必要であります。かかる法的手続きを経ない再生医療等の提供あるいは特定細胞加工物の製造は医療機関において法律違反となり、罰則が科されることとなります。
本サービスにおいて当社は、再生医療を行う医療機関より委託を受けて、医療機関が患者に再生医療を提供する際に必要となる各種申請・届出業務に係る書類作成等のサポート業務を行っております。
当社では、第2種及び第3種再生医療等提供計画書(※)の作成支援を行うほか、法令等により定められた各定期報告書の作成支援、特定細胞加工物製造届出の支援及び法令遵守に関する各種助言等を行っております。
本サービスでは、会計上、当社の提供するサービスが完了した時点で収益を計上しております。
(※)「再生医療等提供計画書」とは、再生医療等安全性確保法第4条第1項に定める、再生医療等を提供する医療機関が認定再生医療等委員会の意見を聴取した上で地方厚生局に提出しなければならない書面です。なお、再生医療に用いられる医療技術は、再生医療等安全性確保法において、人の生命及び健康に与えるリスクの度合いから第1種から第3種に分類され、第1種はiPS細胞やES細胞などを用いた上記のリスクが最も高いもの、第2種は培養した幹細胞などを用いた医療技術等で第1種ほど上記のリスクが高くないもの、第3種は第1種及び第2種以外で最も上記のリスクが低い医療技術等とされています。
③ 医療機器販売
当社は、医療機関の円滑な再生医療の提供を支援することを目的とし、医療機関に対して、患者から血液及び脂肪等の組織を採取するために必要な医療機器を販売しております。
当社では、世界的に販売実績のある医療機器メーカーのMedikan Co., Ltdと国内販売独占契約を締結するなどし、医療機関に販売する医療機器の仕入れ・販売を行っております。
医療機器販売での会計上の収益認識は、一般的な機器販売と同様であります。
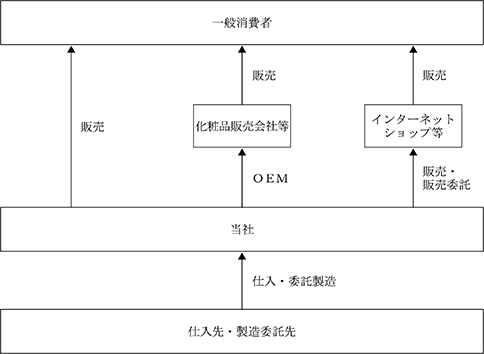
(2) コンシューマー事業
本事業において当社は、当社の再生医療センターでの脂肪由来幹細胞の研究に基づき開発された化粧品ブランド「シグナリフト」の美容液「エクストラエンリッチ」やクリーム「エンリッチクリーム」、洗顔ジェル「ジェリーウォッシュ」等、一般消費者向けの化粧品の製造販売を行うほか、美顔器の通信販売を主に行っております。
当社の化粧品は、再生医療関連事業における脂肪由来幹細胞の研究成果をもとに、肌のハリが生まれるメカニズムに着目して開発された独自成分「シグナペプチド」を配合している点が特徴であります。販売手法は自社Webサイトによる通信販売のほか、インターネットショップや医療機関・ドラッグストアなど店舗への販売になります。また、当社は、化粧品販売事業者からの化粧品のOEM製造を受託しております。なお、当社が販売する化粧品及びOEM製造を受託した化粧品の製造は化粧品製造業許可を取得している外部事業者に委託しております。
本事業での会計上の収益認識は、一般的な化粧品販売と同様であります。
事業の系統図は、次のとおりであります。
(1)再生医療関連事業
(2)コンシューマー事業
4 【関係会社の状況】
該当事項はありません。
5 【従業員の状況】
(1) 提出会社の状況
2019年8月31日現在
(注) 1.平均年間給与は、賞与及び基準外賃金を含んでおります。
2.臨時雇用者は( )内に年間平均雇用人員(月末平均)を外数で記載しております。
3.全社(共通)は、総務及び経理等の管理部門の従業員であります。
4.最近日までの1年間において従業員数が25名増加しております。主な理由は、業容の拡大に伴い期中採用が増加したことによるものであります。
(2) 労働組合の状況
労働組合は結成されておりませんが、労使関係は円滑に推移しております。