第二部 【企業情報】
第1 【企業の概況】
1 【主要な経営指標等の推移】
(注) 1.売上高には、消費税等は含まれておりません。
2.持分法を適用した場合の投資利益については、関連会社がないため記載しておりません。
3.潜在株式調整後1株当たり当期純利益金額については、潜在株式は存在するものの、当社株式は非上場であり、期中平均株価が把握できないため記載しておりません。
4.株価収益率は、当社株式が非上場であるため記載しておりません。
5.第9期、第10期、第12期及び第13期の自己資本利益率については、当期純損失のため、記載しておりません。
6.第9期から第11期についてはキャッシュ・フロー計算書を作成しておりませんので、キャッシュ・フローに係る各項目については記載しておりません。
7.第12期及び第13期の財務諸表については、「財務諸表等の用語、様式及び作成方法に関する規則」(昭和38年大蔵省令第59号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、EY新日本有限責任監査法人の監査を受けておりますが、主要な経営指標等のうち、第9期から第11期については、会社計算規則(平成18年法務省令第13号)の規定に基づき算出した各数値を記載しており、金融商品取引法第193条の2第1項の規定に準ずる監査を受けておりません。
8.当社は、2019年3月1日付で普通株式1株につき100株、2019年3月8日付で普通株式1株につき3株の株式分割を行っておりますが、第12期の期首にこれらの株式分割が行われたと仮定し、1株当たり純資産額及び1株当たり当期純利益金額又は1株当たり当期純損失金額を算定しております。
9. 当社は、2019年3月1日付で普通株式1株につき100株、2019年3月8日付で普通株式1株につき3株の株式分割を行っております。そこで、東京証券取引所自主規制法人(現 日本取引所自主規制法人)の引受担当者宛通知「『新規上場申請のための有価証券報告書(Ⅰの部)』の作成上の留意点について」(平成24年8月21日付東証上審第133号)に基づき、第9期の期首に当該株式分割が行われたと仮定して算定した場合の1株当たり指標の推移を参考までに掲げると、以下のとおりとなります。
なお、第9期、第10期及び第11期の数値(1株当たり配当額についてはすべての数値)については、EY新日本有限責任監査法人の監査を受けておりません。
2 【沿革】
(注)1.「骨髄由来幹細胞動員因子に関する共同研究契約」: HMGB1を候補品とし、医薬品としての開発可能性を検討することを目的とした契約です。
2.「HMGB1」: HMGB1(high mobility group box-1 protein)は、様々な細胞の核内に存在し、DNAと結合して遺伝子発現を制御する核蛋白です。HMGB1は細胞が壊死した際や炎症細胞が活性化した際に細胞外に放出され、細胞遊走、増殖などを誘導し、自然免疫、自然炎症を助ける働きをすると共に、それに続く組織再生反応を活性化することが知られています。
3 【事業の内容】
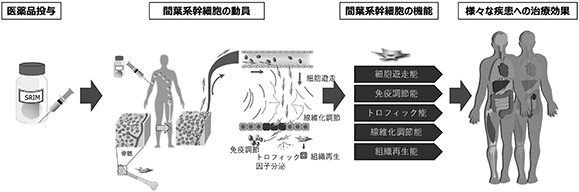
当社が創業以来、その実現を目指し研究開発に取り組んできた「再生誘導医薬」は、怪我や病気により損傷し機能を失った生体組織の機能的再生・治癒を促進する、新しい作用メカニズムにもとづく医薬品です。
再生誘導医薬は、従来型の再生医療(※1)/細胞治療とは異なり、生きた細胞の投与を必要とせず、物質=医薬品の投与によって、患者自身の体内に存在する幹細胞(※2)を活性化する方法で、より簡便かつ安全に、治療効果の高い再生医療を実現します。再生誘導医薬開発により、生きた細胞製剤では難しい安定した品質による迅速な再生医療を実現する製品供給が可能となることから、広く普及可能な新しい再生医療となり得ます。
再生誘導医薬の投与によって患者の体内で誘導される幹細胞は、血液循環を介して体内を巡り、損傷した組織特異的(※3)に集積します。損傷部位に集積した幹細胞は、神経や皮膚、骨、軟骨、筋肉、血管など、様々な種類の組織に分化する能力を有するため、再生誘導医薬という共通のプラットフォームによって、脳梗塞や脊髄損傷などの中枢神経系疾患、心筋梗塞や心筋症などの循環器系疾患、難治性皮膚潰瘍などの上皮系疾患、難治性骨折などの間葉系疾患など、組織損傷をともなう数多くの難病に対して幅広い治療効果をもたらすことが期待されます。
当社で最も開発の進む開発品は、現在、大阪大学医学部附属病院・慶應義塾大学病院・東邦大学医療センターにおいて難治性遺伝性皮膚疾患(表皮水疱症(※4))を対象とした臨床試験(医師主導治験)第Ⅱ相試験(※5)を実施中です。当該開発品をはじめとして、当社はこれまでの研究開発活動を通じて、複数の疾患に対する複数の研究開発パイプライン(医薬品候補群)を保有しており、再生誘導医薬の実現に向けた多面的・多層的な創薬研究開発事業を展開しております。
(1)事業の内容
① 事業モデル
当社は、医薬品の研究開発を主たる業務としております。自社研究若しくは大学等研究機関との共同研究を通じて、生体内における組織再生誘導メカニズム(※6)の解明と幹細胞の特性解析、幹細胞の制御技術(※7)に関する基礎研究をおこない、その成果を活用したスクリーニング(※8)系によって、再生誘導医薬シーズ(※9)の探索をおこなっております。
同定した候補物質については、自社単独若しくは共同研究を実施した大学等研究機関と共同で特許を出願し、研究開発活動の果実である知的財産の構築を進めております。大学等研究機関と共同で出願した特許については、当社が独占的な実施権の許諾を受け、以後の製品化に向けた研究開発を当社主導で進めております。
候補物質については、自社若しくは大学等研究機関/パートナー企業と共同で、製造方法の開発、非臨床薬効薬理試験(※10)、安全性試験(※11)、初期臨床試験等(※12)までを実施し、医薬品開発の成功可能性と知的財産価値を高めたうえで、国内・海外の製薬企業に対して、製品の開発権、製造権、販売権等をライセンスアウトすることで、(a)契約一時金、(b)開発の進捗に応じて支払われるマイルストーン収入、(c)製品上市後に売上高の一定割合が支払われるロイヤリティ収入、(b)売上高に対する目標値を達成するごとに支払われる販売マイルストーン収入等を得る事業モデルを採用しております。
また、パートナー企業とは、ライセンス契約に至る前の比較的早期の研究開発段階において、将来のライセンス契約を前提とした共同研究契約を締結することもあります(事業系統図の(共同研究))。この場合、当社は、パートナー企業から (a)契約一時金、(d)共同研究収入を得ることで、自社の費用負担を低減しつつ、かつパートナー企業の開発リソースも活用することで、研究開発を加速できるメリットを得られます。
当社の事業セグメントは、再生誘導医薬事業のみの単一セグメントであり、事業の系統図及び事業収入の形態は以下の通りであります。
(事業系統図)
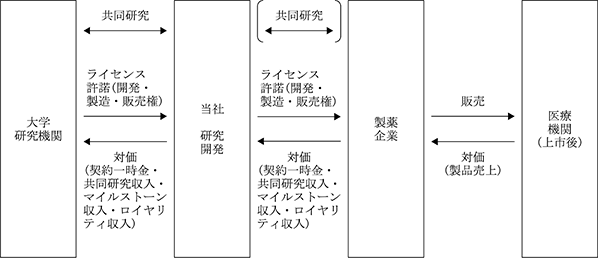
(事業収入の形態)
② 再生誘導医薬について/新しい再生医療
「再生誘導医薬(Stem cell Regeneration-Inducing Medicine)」とは、生きた細胞や組織を用いることなく、医薬品(化合物)の投与のみによって、再生医療と同等の治療効果を得られる医薬品です。
これまでは、怪我や病気で身体の臓器や組織に大規模な損傷や不可逆的な病変による機能不全が生じた場合、一般的な医薬品によってこれを根治することは難しく、その回復には、正常な臓器と取り換える移植医療(心臓移植や腎臓移植等の臓器移植や輸血等)をおこなう他に方法がありませんでした。しかしながら、このような移植医療は、難治性疾患に対する根治療法となり得る一方で、臓器提供者(ドナー)の慢性的な不足と他人の臓器に対する免疫拒絶(※13)反応、また倫理的な問題等から、すべての患者が享受できる、広く普及可能な一般医療にはなり得ません。
この移植医療の限界を突破する技術として、近年注目を集めているのが再生医療/細胞治療です。再生医療/細胞治療は、患者本人若しくは健常なドナー(提供者)から採取した細胞を、生体外で大量に培養することで、治療に必要な十分量の移植用細胞を確保したうえで患者に移植する新しい移植医療技術です。この再生医療/細胞治療は、従来の移植医療が抱える普及への制約を解消し、かつ同等な治療効果を得ることが期待できる新しい再生医療と言えます。
しかしながら、この再生医療/細胞治療についても、その実用化に向けては数多くの解決すべき課題があります。
再生医療/細胞治療は、最終製品として生きた細胞自体を用いる必要があることから、①製造工程における品質管理の難しさ(均質な細胞製剤を安定的に製造することが難しい)、②安全性への懸念(生体外で大量培養する工程で細胞が変質・癌化するリスクがある)、③治療可能時期の制約(自家の細胞を治療に用いる場合、採取から十分量の移植細胞を得るまでに数週間におよぶ細胞培養期間が必要となり急性期~早期治療の機会は失われる)、④免疫拒絶反応(他人から提供された細胞を培養して治療に用いる場合、免疫拒絶の問題が生じる)、⑤保管・流通の制約(冷凍・冷蔵により細胞を生きたまま運搬・保存する際に非常に手間がかかり、保存期間も限られる)など、数多くの構造的な課題を抱えており、一般医療として普及するためには更なる技術革新が必要な状況にあります。
このような背景のもと、当社が大阪大学との共同研究を通じて先駆的な概念を構築し開発を進めてきた「再生誘導医薬」は、製品として生きた細胞を一切用いることなく、『物質(化合物)の投与によって、再生医療/細胞治療を実現する』をコンセプトとする、新しい『再生医療』であります。
再生誘導医薬は、下図に示す作用メカニズムによって、損傷した組織の再生を実現します。
(再生誘導医薬のコンセプト)
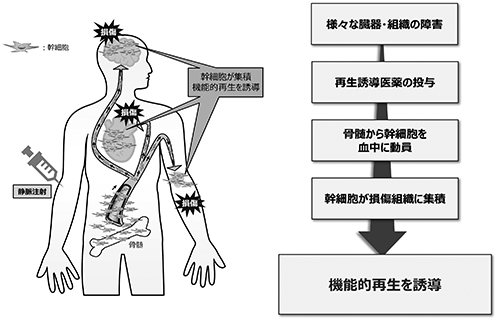
1) 静脈注射等で血液中に再生誘導医薬を投与する。
2) 当該医薬品により患者自身の体内に存在する幹細胞、特に骨髄内に存在する間葉系幹細胞(※14)を刺激し、幹細胞を血液中に放出させる。
3) 骨髄から血液中に放出された間葉系幹細胞は、末梢血循環を介して身体中に運ばれ、損傷により低酸素状態になった組織から放出される特有の化学物質(ケモカイン(※15))を目印に患部に集積する。
4) 患部に集積した間葉系幹細胞は、抗炎症作用を発揮し損傷部位の炎症を鎮め、かつ組織の線維化(瘢痕形成)(※16)を抑制しながら、幹細胞の多分化能(※17)を発揮することで、行き着き生着した組織の環境に応じた、適切な種類の細胞に分化を遂げ、損傷した組織の機能的な再生を促進する。
体外で培養し加工した細胞を用いず、医薬品の投与によって患者自身の体内で間葉系幹細胞の集積誘導による再生医療を実現する再生誘導医薬は、従来型の再生医療が抱える数多くの課題を克服する、革新的な再生医療技術であります。
<細胞治療と比較した場合の再生誘導医薬のメリット>
(ⅰ)品 質: 工業生産可能な化合物医薬品であり品質管理された安定した製造が可能
(ⅱ)安 全: 生体外における細胞培養の工程がないため、細胞や培養液などの材料に由来する不純物による免疫反応、細胞を汚染しているウイルスやバクテリアによる感染症、細胞を培養する過程で生じる細胞の腫瘍化や癌化などのリスクがない
(ⅲ)供 給: 細胞とは異なり、原材料の供給が容易く、製造・保管・管理も容易。従来の医薬品と同じく医療機関(病院、薬局等)に常備しておき、必要な時にいつでも投与が可能。そのため、急性期治療(※18)への利用が可能
(ⅳ)免疫拒絶: 投与するのは本人の幹細胞を動員する化合物医薬品であり、他人の細胞を利用しないため免疫拒絶がない
(2)研究開発の経緯
■ 骨髄間葉系幹細胞の損傷組織への集積による体内組織再生誘導メカニズムの発見
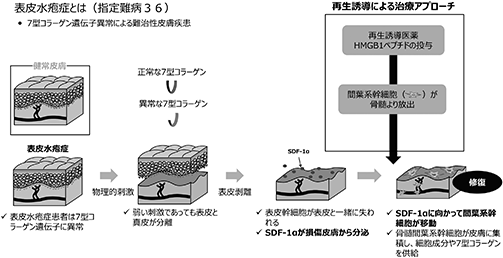
再生誘導医薬開発の発端は、大阪大学で進められていた遺伝性皮膚難病「栄養障害型表皮水疱症(以下、「表皮水疱症」という。)」の病態解明研究から得られた「骨髄由来間葉系幹細胞の損傷組織への集積による組織再生誘導メカニズム」の発見にあります。
当時既に、損傷臓器・組織の再生はそれぞれの臓器・組織に存在する“組織幹細胞”に依存していることは良く知られていました。しかし、表皮水疱症の患者では、皮膚の最外層にある表皮組織の接着に必要な7型コラーゲンが遺伝的に欠損しているため、生まれた直後から全身皮膚の表皮剥離を繰り返し(図1参照)、その結果、表皮内に存在する“表皮幹細胞”が大量に失われてしまいます。表皮幹細胞を失った表皮水疱症の患者は、剥離した表皮を再生できないと容易に予想されます。しかし、患者の表皮は再生能力を維持しているという診療上の観察事実から、骨髄から血液を介した皮膚への幹細胞補充メカニズム仮説が想起されました。
図1
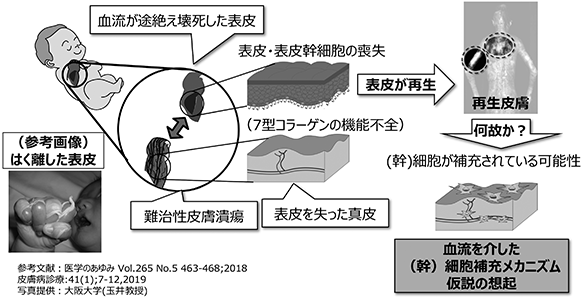
骨髄と各臓器は血管を介して繋がっています。例えば、骨髄から血液に供給された赤血球は全身全ての臓器・組織に酸素を供給し、白血球は免疫作用を、血小板は止血作用を供給しています。その意味において、表皮水疱症の患者の皮膚に生体内で幹細胞が補充されるのだとしたら、血液を介して骨髄から補充されるのではないかという仮説は妥当に思われます。その後、当社創業者でもある大阪大学教授の玉井らによりその仮説が証明されました(出典:Am J Pathol 2008 Sep;173(3)803-14, PNAS 2011 Apr 19;108(16):6609-14,J Immunol. 2015 Feb 15;194(4):1996-2003)。即ち、壊死した表皮細胞の核から放出されたHMGB1が、骨髄内の“間葉系幹細胞”と名付けられた組織再生能力の高い幹細胞を刺激して血中へと動員すること、HMGB1蛋白により血中へと動員された間葉系幹細胞は表皮水疱症皮膚の壊死組織周囲にある血管内皮細胞が産生するケモカインSDF-1α(※19)の作用により壊死組織周囲に集積すること、壊死組織周囲に集積した骨髄由来間葉系幹細胞は、強い抗炎症作用、抗線維化作用、組織再生促進作用を発揮することにより、表皮水疱症の剥離表皮再生を誘導していることが明らかとなりました(図2参照)。
図2
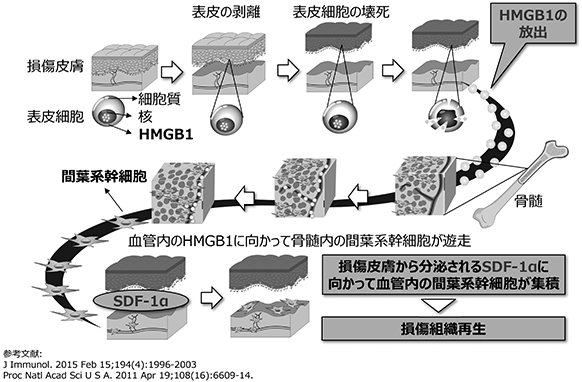
HMGB1蛋白は生体内のあらゆる細胞の核内に存在していることから、これら壊死組織と骨髄間葉系幹細胞のクロストークによる組織再生誘導メカニズムは、皮膚のみならず、生体内のあらゆる臓器・組織の重度壊死性障害において、その再生誘導メカニズムとして作動していると考えられます。
■ HMGB1蛋白の再生誘導医薬としての可能性と想定されたリスク
HMGB1蛋白は、生体内の全ての細胞の核内に存在し、DNAと結合して遺伝子発現を制御する核蛋白であることが40年以上前から知られていました。上述したHMGB1蛋白の骨髄間葉系幹細胞動員活性による組織再生誘導メカニズムの発見は、HMGB1蛋白を静脈内投与して血液中の間葉系幹細胞を人為的に増加させ、その抗炎症作用、抗線維化作用、組織再生促進作用により機能的組織再生を促進する、いわゆる再生誘導医薬としての可能性を生み出しました(出典:Sci Rep. 2015 Jun5;5:11008)。
一方、損傷組織で壊死細胞から細胞外に放出されたHMGB1蛋白は、ヒストンやDNA、あるいは細菌・ウイルス由来因子(※20)と結合すると好中球やマクロファージ(※21)を活性化し、炎症反応を誘導することが近年明らかにされました。即ち、細胞外のHMGB1蛋白は壊死組織や感染組織において自然免疫を活性化し、壊死組織や感染組織除去反応を誘導すると共に、それに続く組織再生反応を活性化する極めて重要な生体内分子であると言えます。しかし、敗血症のような重篤な感染症では、HMGB1蛋白が細菌由来LPS(※22)と血中で結合して全身性に強い病的炎症反応を喚起することが報告されています。これらの事実は、HMGB1蛋白を医薬として静脈内投与した際に、重度な感染症を合併している患者では局所性あるいは全身性に強い炎症反応を喚起してしまうリスクがあることを示しています。
■ 安全性の高いHMGB1ペプチド医薬の開発
HMGB1蛋白はA-box及びB-boxと呼ばれる二つのDNA結合ドメイン(※23)を持ち、炎症反応を誘導する自然免疫活性化ドメインはB-box内に存在することが明らかにされていました。(出典:J Intern Med. 2004 Mar;255(3):351-66.)これらの事実を背景として、当社は大阪大学と共同でHMGB1蛋白の骨髄間葉系幹細胞活性化ドメイン(以下、「KOI2ドメイン」という。)の探索を進め、KOI2ドメインはA-box内に存在することを明らかにしました。即ち、自然免疫活性化ドメインを含まないKOI2ドメインの化学合成ペプチド(以下、「HMGB1ペプチド」という。)は、炎症反応を喚起せずに間葉系幹細胞動員活性のみを持つ、安全性の高い再生誘導ペプチド医薬となることが期待されました。
大阪大学よりHMGB1及びHMGB1ペプチドの独占的実施権を得た当社は、大阪大学及び塩野義製薬株式会社のそれぞれとHMGB1ペプチド創薬の共同研究を推進し、表皮水疱症、脳梗塞、心筋梗塞、虚血性心筋症、拡張型心筋症、脊髄損傷といった、現在有効な治療法の無い難治性疾患の動物モデルにHMGB1ペプチドの静脈内投与が有効であること、炎症反応は全く喚起されないことを証明し、医薬特許取得を精力的に進め、HMGB1ペプチド医薬開発権を塩野義製薬株式会社にライセンスいたしました。
また、ヒトでの安全性及び有効性を確認する目的で行われた、大阪大学における健康成人を対象としたHMGB1ペプチド第Ⅰ相医師主導治験では、HMGB1ペプチドの安全性及び間葉系幹細胞血中動員活性が証明されました。
さらに、2018年に、大阪大学において表皮水疱症患者を対象とした第Ⅱ相試験、塩野義製薬株式会社において脳梗塞治療薬開発のための高齢成人を対象とした第Ⅰ相試験が開始されました。また、大阪大学医学系研究科心臓血管外科学講座では当社との共同研究として心・血管系疾患を対象とした創薬研究が精力的に進められています。
■ 第2世代再生誘導医薬の開発
上述したように、骨髄内に存在する間葉系幹細胞は生体内の壊死細胞が放出するHMGB1蛋白の血中濃度上昇を感知して活性化し、末梢循環を介して壊死組織周囲に集積して組織再生を促進していることが明らかとなりました。これらの発見から、HMGB1蛋白以外の壊死細胞由来因子にもHMGB1蛋白と同様の骨髄間葉系幹細胞活性化作用、組織再生誘導作用がある可能性が想起されました。そこで当社は、大阪大学と共同で壊死細胞から血中放出される可能性のある生体内蛋白を網羅的に探索し、その活性ドメインペプチドの骨髄間葉系幹細胞活性化作用を評価することにより、HMGB1ペプチドと同等あるいはそれ以上の骨髄間葉系幹細胞活性化作用を持つ生体内物質を複数同定いたしました。現在、当社はこれらの第2世代再生誘導医薬候補物質の疾患モデル動物に対する薬効評価を進めています。
(3)技術の優位性
■ 見据えるマーケット
当社の「再生誘導医薬」は、投薬により体内の幹細胞の働きを促進することを作用メカニズムとするため、幹細胞を用いた再生医療・細胞治療が行われている疾患領域を、広くマーケットとして捉えることが可能です。
再生医療細胞治療の上市状況
なお、これまでに世界のいずれかにおいて上市されているヒト幹細胞を利用した再生医療・細胞治療製品(2017年6月末時点)は、日本企業2社・2品目、米国企業3社・5品目、欧州企業2社・2品目(イタリア及びイギリス)、その他(韓国企業6社・7品目、オーストラリア企業1社・1品目、インド企業3社・5品目)を含む、合計17社・22品目です。うち自家幹細胞を用いている製品が13品目、他家が9品目、幹細胞の種類では間葉系の幹細胞を利用している製品が19品目でほとんどを占めています。(参考文献:平成29年度 特許出願技術動向調査報告書(概要)ヒト幹細胞関連技術 特許庁)間葉系幹細胞は再生医療・細胞治療の分野で最も実用化が進んでいる細胞の一つといえます。
間葉系幹細胞を利用した臨床治験は、中枢神経系、骨・軟骨、循環器系などの治療のほかGVHD(※24)に対する免疫寛容療法(※25)など広い疾患領域に対して行われています。(図3参照;Cell Transplantation, Vol. 25, pp. 829–848, 2016より改変し引用)
図3 間葉系幹細胞を利用した疾患領域別、臨床治験件数(総数=493)
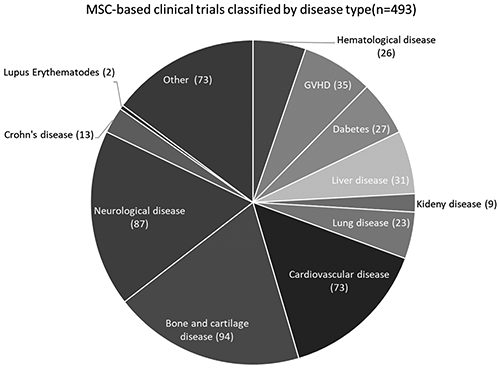
[表中の語句]
間葉系幹細胞を利用した細胞治療が、様々な疾患に対して行われているのは、間葉系幹細胞が有する、様々な細胞種に分化する能力(分化能力)、サイトカイン(※26)・ケモカイン・成長因子(※27)を分泌する能力(トロフィック能力)、免疫応答(※28)を調整する能力(免疫調整能力)、損傷組織に遊走する能力(細胞遊走能力(※29))、線維化を調整する能力(線維化調整能力)があるためと考えられています。(図4参照; Cell Transplantation, Vol. 25, pp. 829–848,2016より引用。図の一部改変。出典:Nat Immunol. 2014 Nov;15(11):1009-16, Stem Cell Trans Med. 2012 Feb;1(2):142-9)
図4
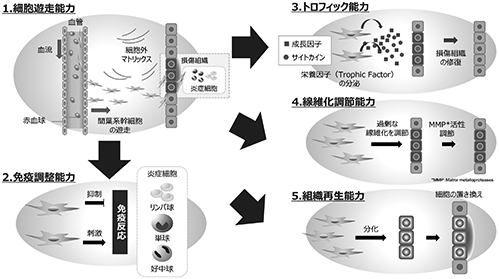
すなわち生体内においては、組織や臓器に損傷を受けると、細胞レベルのダメージを生じ、不可逆的な障害を受けた細胞は壊死します。さらに、傷口から侵入した細菌などを制御する他、壊死した細胞を除去するために、損傷組織には受傷直後から炎症細胞が集まります。間葉系幹細胞は血流を介し損傷組織まで遊走し(細胞遊走能力)、免疫反応を調節し、過剰な炎症による組織損傷の拡大を抑えます(免疫調整能力)。また、損傷組織の細胞に対し成長因子やサイトカインを分泌することで、細胞の増殖や組織の修復を促進します(トロフィック能力)。さらに、間葉系幹細胞自身が、様々な種類の細胞に分化することによって(分化能力)、間葉系幹細胞由来の細胞が損傷組織の細胞に置き換わり組織を再生します。このような間葉系幹細胞の能力は、様々な組織や臓器の再生で効果を発揮するため、多種多様な疾患に対して間葉系幹細胞を細胞治療や再生医療に利用することができるのだと考えられます。
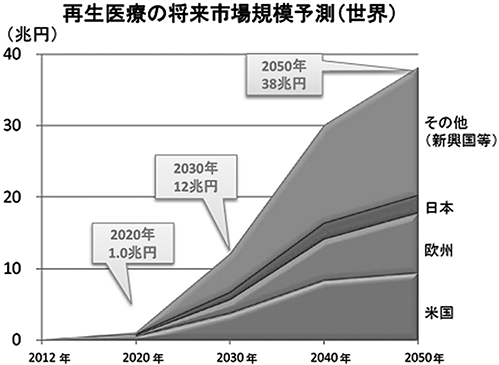
再生医療の市場予測
なお、再生医療の市場規模予測では、国内2020年950億円が2050年2.5兆円、世界2020年1兆円が2050年38兆円と大幅な増加が見込まれており(図5、図6参照;経済産業省再生医療の実用化・産業に関する報告書より抜粋)、従来の医薬や医療では治療が困難であった疾患に対する新たな医療への期待がいかに大きいものかがわかります。
図5
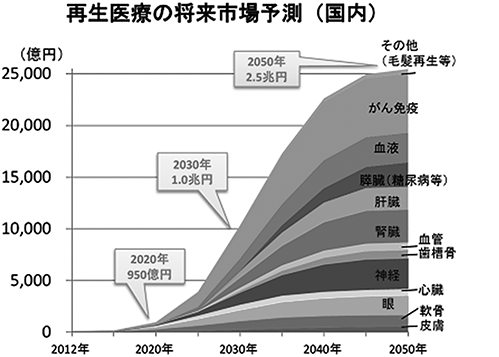
図6
■ 従来技術の特徴と課題
ES細胞、iPS細胞
再生医療や細胞治療の原材料となるのは様々な細胞です。特に、胚性幹細胞(ES細胞)はあらゆる細胞に分化することが可能であり、ほぼ無制限に増殖させることが可能であるため、臓器移植医療の課題であった『移植臓器の不足』が解消されると期待されています。一方で次のような課題も存在します。
[生命倫理上の課題(ES細胞)]
しかし、ES細胞はヒトの生命の萌芽である胚を破壊して作る必要があるため、倫理的課題があります(参考文献:ヒトES細胞の樹立に関する指針 平成31年文部科学省・厚生労働省告示第4号)。さらに近年では、ES細胞のように多能性を有しほぼ無限に増殖可能なiPS細胞が発明され、また、iPS細胞は受精卵を利用せず本人の細胞から作成することが可能であるため、倫理的課題のみではなく免疫拒絶についても解決に向けて大きく前進しました。
[細胞の安全性の課題と医療コストの課題(ES細胞、iPS細胞)]
一方、ES細胞もiPS細胞も無限に増殖するため、増殖の過程で生じる遺伝子の変異や癌化のリスクに対応をする必要があります。
その他の細胞
ES細胞やiPS細胞を使用しない、幹細胞を使用した再生医療/細胞治療としては、自家細胞(自己の細胞=患者本人の細胞)を利用するものと他家細胞(他人の細胞)を利用するものがあります。表皮細胞、筋芽細胞、軟骨細胞、間葉系幹細胞など様々な細胞が再生医療、細胞治療に使用されています。
[自家細胞の課題]
自家細胞では、患者本人から採取した細胞を培養し増殖、加工し使用します。他人の細胞を使用しないので、感染症や免疫拒絶のリスクを最小限に抑えることができますが、一人の患者から採取できる細胞の量に限界があります。また、ES細胞やiPS細胞とは違い細胞を無限に増殖させることができないため、治療に十分な細胞を用意することが課題となります。また、オーダーメイドで作成する必要があるため、急性期の治療が困難で、治療費が高額になるという課題があります。
[他家細胞の課題]
他家細胞では、多数のドナーから細胞の提供を受け、細胞バンクに細胞を保存しておくことで、急性期の治療にも対応でき、医療コストも抑えることができますが、ドナーに由来する未知の感染症や免疫拒絶のリスクがあります。(参考文献:経済産業省 「再生医療の実用化・産業に関する研究会」の最終報告書)
[間葉系幹細胞の課題]
ほぼ無限に増殖することが可能なES細胞やiPS細胞とは異なり、間葉系幹細胞が増殖する能力には限界があります。間葉系幹細胞は、細胞分裂を繰り返す過程で細胞の老化現象(senescence)を起こし、分化能力や免疫調整能力や細胞遊走能力という細胞治療の効果に寄与する重要な能力が失われることが知られています。このため、間葉系幹細胞を使用した医療を広く行うためには、継続的に大量の細胞を供給する必要があります。すなわち、多数のドナーの骨髄から細胞を採取し、大量の細胞を確保しなければならず、一般的な医療とするためには、原材料の供給の面で課題があるといえます。(出典:Stem Cells Transl Med. 2017 Dec;6(12):2173-2185.)
[細胞を利用する再生医療や細胞治療の課題]
このように、再生医療や細胞治療は、これまでにない新しい医療で、従来の医療では治療困難な疾患に対して優れた治療効果があるものの、既存の医薬品と異なり生きた細胞を治療用に使用するため、従来の医薬品では問題にならなかった、様々な課題を解決する必要があります。(参考文献:平成26年度 「再生医療の産業化に向けた評価基盤技術開発事業」原料細胞の入手等に関する調査等報告書)
■ 再生誘導医薬(当社シーズ)による課題の解決
再生誘導医薬は、生体内に存在する骨髄間葉系幹細胞を損傷組織へ動員する、生体が元来有する治癒能力を促進する医薬です。損傷組織を直接治療するのは、薬剤の投与によって損傷組織に動員された間葉系幹細胞であるため、間葉系幹細胞の特徴である、細胞遊走能、免疫調整能、トロフィック能、線維化調整能、組織再生能等によって一つの物質で広範な疾患領域に対する適応が期待できます(図7参照)。また、投与するのはペプチド、タンパクなどの物質であり、従来の医薬品と同じ方法で製造、輸送、保管、投与が可能です。そのため、再生医療や細胞治療の様々な課題を解決しながら、従来の医療では治療困難であった疾患を治療のターゲットとすることができます。
図7
(4)当社技術のターゲットとなる適応症
間葉系幹細胞を使用した細胞治療の効果がある疾患領域や病態が治療のターゲットとなります。以下のように広い疾患領域や様々な病態が適応症として期待できます。
■ 再生誘導医薬の適応症として期待される疾患領域・病態
<疾患領域>
中枢神経系疾患(脳梗塞、脊髄損傷、筋萎縮性側索硬化症)、循環器系疾患(心筋梗塞、心筋症)、消化器系疾患(潰瘍性大腸炎)、上皮系疾患(難治性皮膚潰瘍)、骨格・運動器系疾患(※30)(骨損傷、軟骨損傷、骨格筋損傷)、内分泌系疾患(※31)(糖尿病)、呼吸器系疾患(※32)(肺線維症)、免疫系疾患(膠原病一般)等
(下線の疾患は当社再生誘導医薬候補品による改善効果確認済み)
<病態>
損傷性疾患(脳梗塞、心筋梗塞、脊髄損傷、難治性皮膚潰瘍)、
免疫異常/炎症性疾患(潰瘍性大腸炎、アトピー性皮膚炎、GVHD)、
線維化疾患(肝臓線維化、肺線維化など、皮膚線維化、術後瘢痕)等
(下線の疾患は当社再生誘導医薬候補品による改善効果確認済み)
■ 治療用自己細胞採取デバイス
<疾患領域>
上皮系疾患(難治性皮膚潰瘍)、骨格・運動器系疾患(骨軟骨損傷、骨格筋損傷)等
<病態>
損傷性疾患(難治性皮膚潰瘍、骨軟骨損傷など)等
■ 幹細胞遺伝子治療
<適応疾患>
遺伝性疾患
(5)パイプラインの概要
当社の手掛ける研究開発パイプラインとその進捗状況は以下の通りであります。パイプラインは、以下5つのプロジェクト(PJ1~PJ5)に分類されます。
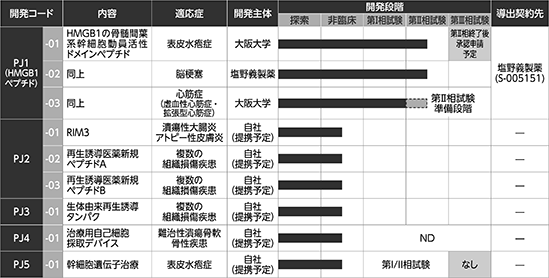
※ PJ1 -01について、対象となる栄養障害型表皮水疱症の患者数は、全国に200名前後、年間あたりの新規患者数は15名程度と想定されており、大規模な第Ⅲ相試験を計画することが困難です。また、栄養障害型表皮水疱症は、希少難治性疾患であり現在有効な治療法がありません。したがって、当社としては、第Ⅱ相試験の結果を踏まえ、医薬品の承認申請を行うことを見込んでおります。
※ PJ4 -01について、第Ⅰ相試験以降は、現在、実施しない方向で調整中ですが、未確定のためNDと記載しております。
各パイプラインの主な市場ターゲットは、日本、米国、欧州などです。
各パイプラインの概要は、以下のとおりです。
(6)研究開発パイプライン
(A)PJ1 再生誘導医薬_HMGB1ペプチド
① PJ1-01 表皮水疱症治療薬
(適応症: 表皮水疱症(栄養障害型))
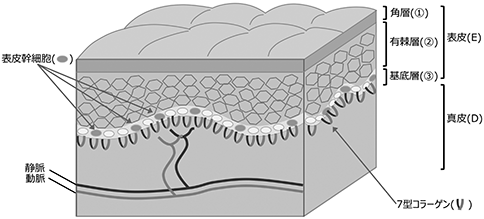
皮膚は、表皮(E)と真皮(D)からなる2層の構造をとっています。表皮もまた体の外側から角層(①)、有棘層(②)、基底層(③)と層構造をとっています(図8参照)。基底層には表皮細胞の幹細胞(表皮幹細胞)が存在します。幹細胞から分裂した未分化な表皮細胞は次第に分化して体の外側へと移動します。一番外側まで移動すると、角質となって体のバリアーを形成し体内の水分を保持するほか、外界からの刺激やバクテリアなどの感染症から体の内部を守っています。表皮の直下にある真皮は1型コラーゲンという蛋白を主成分とする組織で皮膚に物理的な強さを与えるほか水分を保持しています。
図8
皮膚は特殊な『糊』によって表皮と真皮がしっかりと接着しています。強い機械的刺激でも表皮が皮膚からはがれることはありません。表皮と真皮を接着させる『糊』の役割をしているのが、表皮細胞や真皮に存在する線維芽細胞から分泌される7型コラーゲンと呼ばれるタンパクです。7型コラーゲンに異常があると『糊』としての機能が低下して表皮と真皮を接着する力が弱くなり、弱い刺激であっても表皮が真皮からはがれてしまいます(図9参照)。
はがれた表皮と真皮の間には組織液がたまり水ぶくれ(水疱)が生じます。水疱が破れると潰瘍となり、治癒が追い付かずに傷が遷延化(※39)すると、瘢痕化(線維化)し皮膚がひきつれるために関節などが動かないようになってしまいます。
表皮水疱症の患者は7型コラーゲンの遺伝子に異常があるため、機械的刺激により容易に表皮と真皮の間が裂けます。その結果出生時から全身の皮膚に水ぶくれができ、生涯にわたり症状が続きます。遺伝子治療をのぞいて現時点で根治的な治療法はありません。
図9
前述のように、表皮水疱症では、表皮が剥離する際に表皮幹細胞が失われてしまうため、新しい表皮を再生することが困難な状態になります。骨髄間葉系幹細胞は皮膚に集積することによって、細胞成分や7型コラーゲンを供給します。病因である7型コラーゲンの異常があるため、完治はできませんが、難治性皮膚潰瘍などの症状の改善が期待できます。
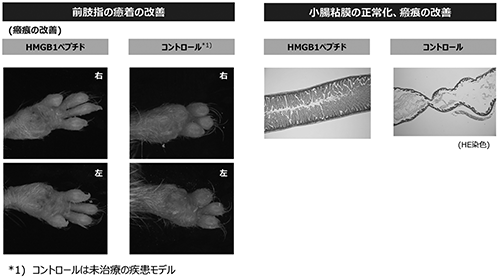
(薬効試験の結果)
表皮水疱症のモデル動物を使用したHMGB1ペプチドの非臨床薬効試験では、治療群において指の癒着が改善されました(図10参照)。また、骨髄間葉系幹細胞が皮膚に動員されると、7型コラーゲンを分泌するようになることが明らかになりました。皮膚ばかりではなく7型コラーゲンを同じように分泌する消化管の症状(消化管上皮の脱落、消化管の瘢痕化)も緩和し、さらに延命率も改善しております(図11参照)。遺伝子異常を原因とする7型コラーゲンに機能の低下があっても、骨髄間葉系幹細胞を患部に動員することにより症状が改善されました。
② PJ1-02 脳梗塞治療薬
(適応症: 脳梗塞について)
脳梗塞は、主に脳に酸素や栄養を供給する血管が血栓によって閉そくすることが原因で生じる疾患です。脳は低酸素状態に極めて弱く、また一度障害を受けると再生をすることが極めて困難な臓器であるため、これまで有効な治療はほとんどありませんでした。血栓を溶解させる薬(血栓溶解剤)が有効ですが、発症初期の数時間後までにしか使用できないため、一部の患者にしか投与されていません。血栓溶解剤を投与できなかった場合や投与されても十分な効果が得られなかった場合、脳梗塞によって生じる麻痺などの治療はリハビリテーションなどによって治療が行われています。骨髄間葉系幹細胞による細胞治療は、免疫寛容効果による炎症の抑制や、トロフィック効果による組織再生を期待されています。しかし、患者本人の骨髄間葉系幹細胞を利用する場合、細胞採取の後、細胞培養による増殖工程にかかる時間が必要であり、発症後すぐに患者に投与することができません。また、高額な医療コストなどの課題があります。再生誘導医薬は、タンパクやペプチドなどの従来の医薬と同様に扱うことが可能であり、必要時にすぐに使用することが可能です。また、骨髄採取や細胞培養の設備が必要ないため、一般の病院においても治療を行うことが可能です。
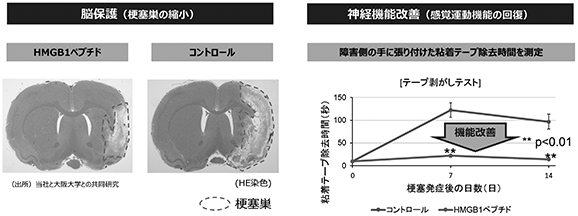
薬効試験の結果
脳梗塞のモデル動物を使用したHMGB1ペプチドの非臨床試験では、治療によって脳梗塞の病巣の大きさを減少させるとともに、神経系の機能試験で有意な回復が認められています(図12参照)。
図12
③ PJ1-03 心筋症治療薬
(適応症: 心筋症について)
心臓は全身の臓器に血液を送り出すポンプの役割を果たしています。心臓は心筋と呼ばれる筋肉でできていて心筋が伸びる際に血液を心臓に取り込み、心筋が縮む際に血液を心臓から送り出します。心筋症は、心筋が線維化などによって伸縮が不良になり心臓のポンプ機能が障害される疾患です。心筋症の原因は、心筋梗塞や狭心症などの虚血性心疾患、高血圧、アルコールの多飲等が知られていますが、これらの原因が明らかな心筋症を特定(2次性)心筋症とし、原因が不明な特発性心筋症とに区分されます。
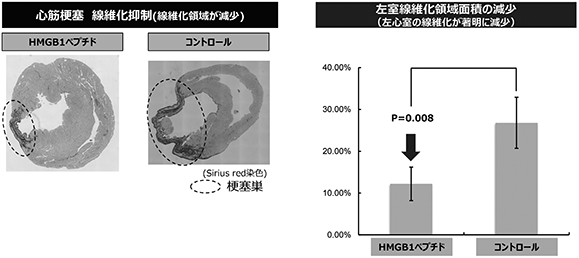
(薬効試験の結果)
心筋梗塞モデルラットに対し、虚血(※40)後2週間後にHMGB1を投与しました。治療の心筋の壊死部サイズの縮小効果が認められています(図13参照)。また、HMGB1ペプチドを投与した心筋梗塞モデルラットは、未治療のコントロール群(※41)に比較して有意に心臓の線維化の減少が認められています。(図14参照)
その他HMGB1ペプチドによる効果(非臨床試験)が確認されているのは以下の通りです。下記以外にも様々な疾患に対して適応症の拡大が期待されます。
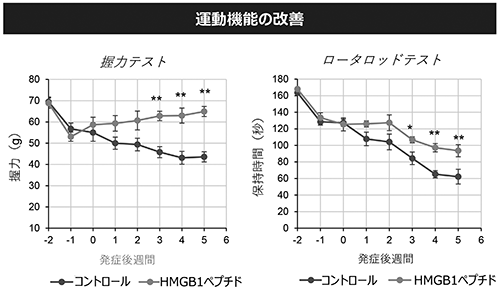
(ⅰ)筋萎縮性側索硬化症(ALS)
マウスのALSモデル(※42)において、HMGB1ペプチドの投与により、投与開始3週間後以降の握力低下及びロッド上での保持時間(※43)の低下を有意に改善しました(図15参照)。
図15
(ⅱ)潰瘍性大腸炎の治療
DSS(※44)投与によって作成したマウスの潰瘍性大腸炎モデルにおいて、大腸(結腸)のびらん・潰瘍はHMGB1ペプチドの投与により著明に改善しました(図16参照)。
図16

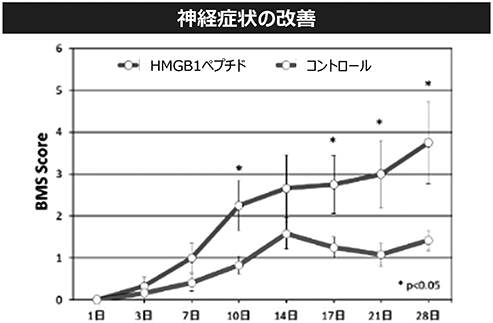
(ⅲ)脊髄損傷の治療
神経症状の回復をBMSスコア(※45)を用いて評価した結果、脊髄損傷作成後、10、17、21、28日目において、非治療群に比較しHMGB1ペプチド投与群は有意なスコアの改善を示し、神経症状の改善効果が確認されました(図17参照)。
図17
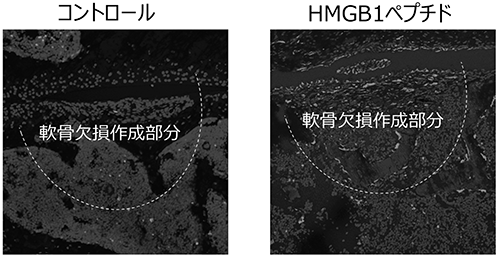
(ⅳ)軟骨再生①
マウス膝関節に軟骨欠損を作成する外傷性軟骨損傷モデルで、2週間後、4週間後、8週間後、12週間後の病理組織の評価(サフラニン-O染色(※46))を行ったところ、12週間後において、HMGB1ペプチド投与で明らかな軟骨の再生が確認されました(図18「▼▼▼」参照)。
図18

(ⅴ)軟骨再生②
胎生期に生じる外胚葉性間葉系幹細胞を赤色蛍光タンパクで出生後にトレース(※47)するために作成したマウスを作成し、これと野生型のマウスを皮膚で接合し血流を共有させました。野生型マウスの膝関節に軟骨欠損を作成し、もう一方のマウスに対しHMGB1ペプチドを投与したところ、損傷軟骨部分に赤色蛍光タンパクを発現する細胞が集積し、一方でペプチドを投与しないマウス(コントロール)では、同様の細胞は殆ど集積しませんでした(図19参照)。HMGB1ペプチドの投与により、損傷組織に動員され組織を再生したのは外胚葉性間葉系幹細胞に由来する細胞であると考えられました。
図19
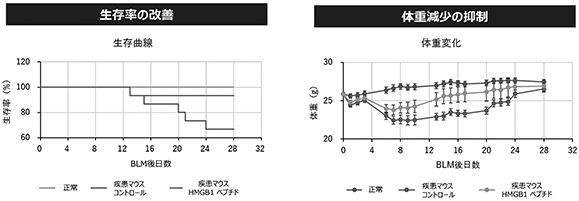
(ⅵ)肺線維症
マウスブレオマイシン(BML)(※48)誘発肺線維症モデルでは、HMGB1ペプチド投与により生存率の改善と、体重減少の抑制効果が示されております(図20参照)。
図20
(ⅶ)外傷性脳損傷
脳皮質への外傷性脳損傷モデルでは、右脳への受傷後にHMGB1ペプチドを投与することによって、脳損傷の抑制効果が示されております。無治療のコントロールマウスでは、外傷性損傷による脳皮質部分(▼)の欠損が認められますが、HMGB1ペプチド投与マウスでは欠損の抑制が認められます(図21左参照)。また、右脳の残存する脳皮質(左図青色の面積)に対する同一個体の左脳皮質(左図赤色の面積)の割合を比較したところ、無治療のコントロールマウス群に対し、HMGB1投与群では有意に右脳の脳皮質が保たれており(図21右参照)、HMGB1の薬効が確認されました。
図21

(ⅷ)肝硬変
薬剤(四塩化炭素)誘発肝硬変モデルでは、HMGB1ペプチドを投与することによって、肝障害の抑制効果が示されております。肝逸脱酵素であるAST(アスパラギン酸アミノトランスフェラーゼ)やALT(アラニンアミノトランスフェラーゼ)、血中アルブミンやビリルビンの値(※49)が著明に改善し、線維化の指標である尿中Hydroxyprolineの低下や病理組織像においても改善が認められており、HMGB1ペプチドの薬効が確認されました。(出所 新潟大学 寺井崇二教授)
(B)PJ2 再生誘導医薬新規ペプチド
■骨髄間葉系幹細胞を骨髄内から血中に動員する薬(新規物質)
当社は骨髄間葉系幹細胞による損傷組織の再生や再生誘導物質を発見して以来、骨髄中に存在する間葉系幹細胞、血流中に存在する間葉系幹細胞、損傷組織に存在する間葉系幹細胞など生体に存在する自然の状態の細胞に注目し研究を続けてきました。それらの知見をもとに新たに開発した間葉系幹細胞血中動員活性のスクリーニング法と組み合わせることで再生誘導医薬の研究を加速しています。
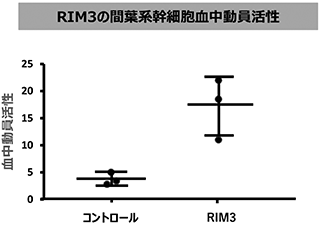
以上のような基礎的な研究の結果、生体内に存在する骨髄間葉系幹細胞に対する新たな知見を積み重ね、新規骨髄間葉系幹細胞の血中動員新規合成ペプチド(RIM3)を得ることができました(図22参照)。
図22
(i)潰瘍性大腸炎モデル
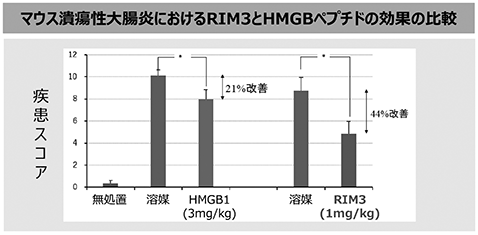
さらに、マウスの潰瘍性大腸炎モデルにおいては、コントロール(未治療)に比較し、RIM3投与によって大腸の損傷が改善し(図23参照)、疾患スコア(※50)においてはHMGB1以上の改善が認められており、優れた治療効果が示されています(図24参照)。
図23
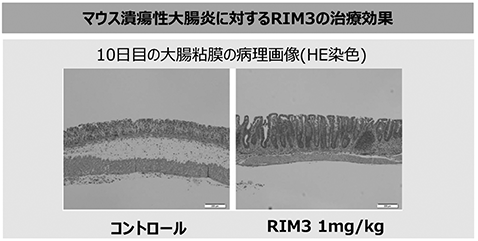
図24
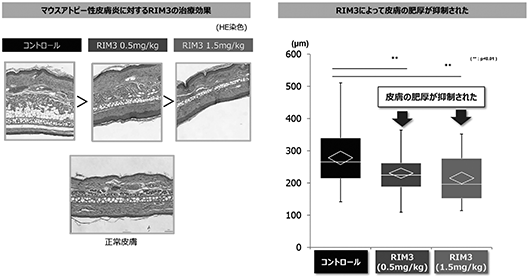
(ⅱ)アトピー性皮膚炎
マウスMC903(topical)誘発(※51)アトピー性皮膚炎モデルでは、耳介に限局した皮膚炎を生じますが、RIM3投与により、皮膚病理組織における炎症所見の改善と、皮膚の肥厚の抑制が確認され症状の改善が認められました(図25、図26参照)。
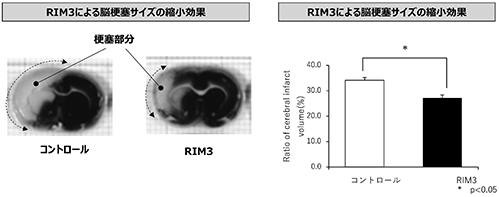
(ⅲ)脳梗塞
薬効試験の結果、脳梗塞のモデル動物を使用したRIM3(2mg/kg)の非臨床試験では、未治療のコントロールに比較して脳梗塞サイズ(下図の白色部分)を縮小させる効果が認められました(図27、図28参照)。
(C)PJ3 生体由来再生誘導タンパク
■ 骨髄間葉系幹細胞動員物質分泌促進剤
PJ1及びPJ2の開発品は、骨髄内の間葉系幹細胞を刺激して、骨髄から間葉系幹細胞を血中に動員する物質です。一方、PJ3では、損傷組織から間葉系幹細胞動員物質の分泌を増加させる物質を開発します。
HMGB1ペプチドとは作用メカニズムが異なるため、HMGB1ペプチドと併用若しくは単独で使用することによって、再生誘導医療の対象疾患の拡大が期待できます。特に、損傷組織が小さい病態においては、虚血領域も小さいため、低酸素状態で分泌量が増大するSDF-1αの量が少なく、間葉系幹細胞が損傷個所に集積できない恐れがあります。そのようなときに、本物質を患部周囲へ投与することで、循環血流中の間葉系幹細胞を治療する臓器に集積させる効果を狙います。
応用例としては、HMGB1ペプチド投与によって、末梢循環血流中に増加した間葉系幹細胞を、PJ3の開発品投与によって末梢循環血流中から損傷組織に効率的に集積させることが考えられます。
図29

(D)PJ4 治療用自己細胞採取デバイス
■ 自己の骨髄間葉系幹細胞をデバイス内に集積させ体外に回収後、損傷部位の細胞治療に利用する技術
骨髄間葉系幹細胞の動員因子をデバイス内に挿入し、皮下など生体内に埋没することで生体内に存在する細胞を直接回収する技術を開発しています。現在、実験動物を使用した非臨床の研究を行っております。臨床の場面では、医師によって患者本人の皮膚に局所麻酔を行った後、数mmから数cmの皮膚切開をします。あらかじめ骨髄間葉系幹細胞の動員因子(※52)を挿入しておいたデバイスを、切開した皮膚から皮下に挿入します。挿入後数日経過した後にデバイスを体外に取り出し、デバイス内に集積した細胞を損傷組織(患部)に直接投与します。デバイスを挿入する手術も、外来通院にて施行可能な程度の簡単な手術となります(図30参照)。
図30
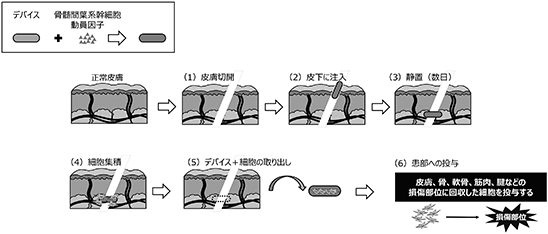
再生誘導医療デバイスの特徴は下表の通りです。体外で培養する工程や細胞を加工する工程がないため、セルプロセッシングセンター(※53)が必要なく、細胞の製造、保管、輸送にかかわるコストを削減できるため、低コストで細胞治療を行うことができます。
間葉系幹細胞は様々な組織(神経系、循環器系、上皮系、間葉系)の疾患の治療に応用することができるため、本技術の治療対象は広範な領域となることが期待されます。
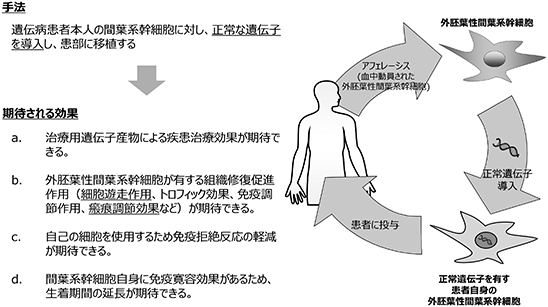
(E)PJ5 幹細胞遺伝子治療
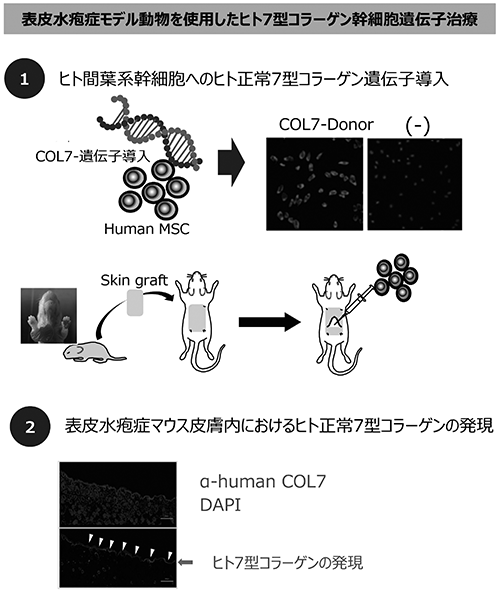
■ 遺伝性疾患の患者本人の間葉系幹細胞を採取し、体外で病因となる遺伝子の修復を行う技術です。
一般に、遺伝子治療では病変臓器の幹細胞を治療対象とするため、疾患ごとに様々な臓器の幹細胞に対して遺伝子治療を施さなければなりません。ヒト間葉系幹細胞に正常な7型コラーゲンを遺伝子導入し、表皮水疱症モデルマウスの皮膚に細胞移植しました。その結果、ヒト由来の7型コラーゲンがマウスの皮膚で正常に機能していることが証明されました。間葉系幹細胞は、多分化能の他にも、免疫調節能などを有し、様々な疾患に対して治療効果を有するため、間葉系幹細胞を遺伝子治療の対象にすることにより、様々な遺伝性疾患に対する治療が期待できます。
図31
(7)再生誘導医療の可能性
再生誘導医療は、元来生体が持っている損傷組織の再生能力を、生体内に存在する幹細胞を体外で人工的な操作(培養や加工など)することなく、生体内で活性化することで、難治性の疾患の治癒を目指す医療です。現在、当社では、骨髄に存在する間葉系幹細胞を血中に動員する再生誘導医薬、血中に存在する間葉系幹細胞を損傷組織に集積する再生誘導医薬、血中に存在する間葉系幹細胞を皮下に埋めたデバイス内に集積させ細胞治療に利用する医療、間葉系幹細胞を標的とした遺伝子治療と細胞治療のハイブリッド医療の研究開発を行っています。
再生誘導医薬の場合、薬が患部に直接作用するのではなく、骨髄や血液などに存在する幹細胞に作用することが特徴です。患部を治療するのはあくまで生体に存在する活性化された幹細胞です。生体内に存在する幹細胞の理解を深めることで、再生誘導医療を発展させることが可能になります。
現在、日進月歩で幹細胞の研究が進んでおり、当社においても幹細胞の最新の知見をもとに、難治性疾患に対する新たな再生誘導医薬の開発を進めています。
(8)用語解説
4 【関係会社の状況】
該当事項はありません。
5 【従業員の状況】
(1) 提出会社の状況
(注) 1.従業員数は、就業員数(契約社員、常用パートを含む。)であります。なお、臨時雇用者数(派遣社員)は、( )内に外数で記載しております。
2.平均年間給与は、賞与及び基準外賃金を含んでおります。
3.当社は単一セグメントであるため、セグメント情報との関連は記載しておりません。
(2) 労働組合の状況
当社の労働組合は、結成されておりませんが、労使関係は円満な関係にあり、特記すべき事項はありません。