第二部【企業情報】
第1【企業の概況】
1【主要な経営指標等の推移】
(1) 連結経営指標等
|
回次 |
国際会計基準 |
||
|
第7期 |
第8期 |
||
|
決算年月 |
2014年12月 |
2015年12月 |
|
|
売上収益 |
(千円) |
|
|
|
税引前当期損失 |
(千円) |
△ |
△ |
|
親会社の所有者に帰属する当期損失 |
(千円) |
△ |
△ |
|
親会社の所有者に帰属する当期包括損失 |
(千円) |
△ |
△ |
|
親会社の所有者に帰属する持分 |
(千円) |
|
|
|
総資産額 |
(千円) |
|
|
|
1株当たり親会社の所有者帰属持分 |
(円) |
△ |
△ |
|
基本的1株当たり当期損失 |
(円) |
△ |
△ |
|
希薄化後1株当たり当期損失 |
(円) |
△ |
△ |
|
親会社所有者帰属持分比率 |
(%) |
|
|
|
親会社所有者帰属持分当期利益率 |
(%) |
|
|
|
株価収益率 |
(倍) |
|
|
|
営業活動によるキャッシュ・フロー |
(千円) |
△ |
△ |
|
投資活動によるキャッシュ・フロー |
(千円) |
△ |
△ |
|
財務活動によるキャッシュ・フロー |
(千円) |
|
|
|
現金及び現金同等物の期末残高 |
(千円) |
|
|
|
従業員数 |
(人) |
|
|
|
(外、平均臨時雇用者数) |
( |
( |
|
(注)1.上記指標は、国際会計基準により作成しています。
2.売上収益には、消費税等は含まれていません。
3.希薄化後1株当たり当期損失金額は、ストック・オプション及び転換社債型新株予約権付社債が逆希薄化効果を有するため、基本的1株当たり当期損失と同額にて表示しています。
4.親会社所有者帰属持分当期利益率は、当期損益が損失であるため、記載していません。
5.株価収益率は、当社株式が非上場であるため、記載していません。
6.従業員数は就業人員です。
7.第7期及び第8期の国際会計基準に基づく連結財務諸表は、金融商品取引法第193条の2第1項の規定に基づき、三優監査法人による監査を受けています。
(2) 提出会社の経営指標等
|
回次 |
日本基準 |
|||||
|
第4期 |
第5期 |
第6期 |
第7期 |
第8期 |
||
|
決算年月 |
2011年12月 |
2012年12月 |
2013年12月 |
2014年12月 |
2015年12月 |
|
|
売上高 |
(千円) |
|
|
|
|
|
|
経常損失 |
(千円) |
△ |
△ |
△ |
△ |
△ |
|
当期純損失 |
(千円) |
△ |
△ |
△ |
△ |
△ |
|
資本金 |
(千円) |
|
|
|
|
|
|
発行済株式総数 |
(株) |
|
|
|
|
|
|
普通株式 |
|
|
|
|
|
|
|
A種優先株式 |
|
|
|
|
|
|
|
B種優先株式 |
|
|
|
|
|
|
|
C種優先株式 |
|
|
|
|
|
|
|
D種優先株式 |
|
|
|
|
|
|
|
純資産額 |
(千円) |
|
|
△ |
△ |
△ |
|
総資産額 |
(千円) |
|
|
|
|
|
|
1株当たり純資産額 |
(円) |
△ |
△ |
△ |
△ |
△ |
|
1株当たり配当額 |
(円) |
|
|
|
|
|
|
(うち1株当たり中間配当額) |
( |
( |
( |
( |
( |
|
|
1株当たり当期純損失金額 |
(円) |
△ |
△ |
△ |
△ |
△ |
|
潜在株式調整後1株当たり当期純利益金額 |
(円) |
|
|
|
|
|
|
自己資本比率 |
(%) |
|
|
△ |
△ |
△ |
|
自己資本利益率 |
(%) |
|
|
|
|
|
|
株価収益率 |
(倍) |
|
|
|
|
|
|
配当性向 |
(%) |
|
|
|
|
|
|
従業員数 |
(人) |
|
|
|
|
|
|
(外、平均臨時雇用者数) |
( |
( |
( |
( |
( |
|
(注)1.売上高には、消費税等は含まれていません。
2.1株当たり配当額は、配当を実施していないため、記載していません。
3.潜在株式調整後1株当たり当期純利益金額は、1株当たり当期純損失金額であるため、記載していません。
4.自己資本利益率は、当期純損益が損失であるため、記載していません。
5.株価収益率は、当社株式は非上場であるため、記載していません。
6.配当性向は、配当を実施していないため、記載していません。
7.従業員数は就業人員です。
8.第7期及び第8期の財務諸表は、「財務諸表等の用語、様式及び作成方法に関する規則」(1963年大蔵省令第59号)に基づき作成しており、金融商品取引法第193条の2第1項の規定に基づき、三優監査法人による監査を受けています。なお、第4期、第5期及び第6期の財務諸表は、「会社計算規則」(2006年法務省令第13号)の規定に基づき算出した数値を記載しており、金融商品取引法第193条の2第1項の規定に基づく監査を受けていません。
2【沿革】
|
2006年12月 |
当社医薬品開発事業の準備拠点として、JapanBridge Inc.を米国に設立 |
|
2007年1月 |
バジャカラ株式会社(現当社)設立 |
|
2008年4月 |
JapanBridge Inc.が当社を買収し、JapanBridge Inc.より医薬品開発事業を承継 ジャパンブリッジ株式会社(現当社)に商号を変更 |
|
2008年5月 |
開発品SP-01 Sancuso®の日本、台湾、シンガポール、マレーシア、中国(香港、マカオ含む)での独占的開発販売権をStrakan International Ltd.(現Strakan International S.A.)(英国)より導入。なお、日本での独占的開発販売権は2011年1月にStrakan International Ltd.に返還 |
|
2008年9月 |
ソレイジア・ファーマ株式会社に商号を変更 |
|
2010年2月 |
開発品SP-01 Sancuso®の台湾、香港、シンガポール、マレーシアでの独占的開発販売権を協和発酵キリン株式会社に導出 |
|
2011年3月 |
開発品SP-02 darinaparsinのアジア太平洋地域での独占的開発販売権をZIOPHARM Oncology, Inc.(米国)より導入 |
|
2011年12月 |
中国での開発活動を目的として北京に当社代表事務所を開設 |
|
2013年1月 |
中国での販売活動準備を目的として上海に事務所を開設 |
|
2014年6月 |
開発品SP-01 Sancuso®の中国における新薬承認申請 |
|
2014年7月 |
開発品SP-02 darinaparsinの米国、欧州諸国の独占的開発販売権をZIOPHARM Oncology, Inc.(米国)より導入 |
|
2014年9月 |
開発品SP-01 Sancuso®のマカオでの独占的開発販売権を協和発酵キリン株式会社に導出 |
|
2014年12月 |
中国上海に、当社製品の医薬情報提供を行うための子会社(Solasia Medical Information Consulting (Shanghai) Co. Ltd.)を設立 |
|
2015年1月 |
開発品SP-02 darinaparsinの日本での独占的開発販売権をMeiji Seika ファルマ株式会社に導出 |
|
2015年3月 |
開発品SP-03 episil®の日本、中国での独占的開発販売権をCamurus AB(スウェーデン)より導入 |
|
2015年11月 |
開発品SP-01 Sancuso®の中国(北京、上海、広州、香港、マカオを除く)での独占的販売権をLee's Pharmaceutical (HK) Limitedに導出 |
|
2016年5月 |
開発品SP-03 episil®の中国における医療機器製造販売承認申請 |
|
2016年10月 |
開発品SP-03 episil®の日本における医療機器製造販売承認申請 |
|
2016年11月 |
開発品SP-03 episil®の日本での独占的販売権をMeiji Seika ファルマ株式会社に導出 |
|
2017年2月 |
開発品SP-03 episil®の中国(北京、上海、広州を除く)での独占的販売権をLee's Pharmaceutical (HK) Limitedに導出 |
3【事業の内容】
当社は日本及びアジア諸国の医療に貢献するため、海外又は国内の製薬企業又はバイオベンチャー企業から有望な新薬候補品を導入し、日本及びアジア諸国における臨床試験を中心とした開発活動を通じ、製品を医薬品市場に供給することを目的として、2006年に創業した企業です。創業に際しては、事業準備拠点としてJapanBridge Inc.をまず米国に設立し、2008年4月にJapanBridge Inc.がバジャカラ株式会社(現当社)の発行済株式をすべて取得して、これを日本での事業活動の主体とすることとしました。同時にJapanBridge Inc.での事業準備成果が当社に承継され、商号をジャパンブリッジ株式会社に変更し、事業活動を本格的に開始しました。
本書提出日現在、当社グループは、当社と連結子会社であるSolasia Medical Information Consulting (Shanghai) Co. Ltd. の2社で構成されており、3種類の医薬品又は医療機器の開発パイプラインを有しています。
当社グループの事業系統図は下記のとおりです。なお、医薬候補品等の導入、導出契約における経済条件(支払条件)は、主に以下の形態の取引によって構成されます。
・契約一時金 :導入導出契約を契機として導入側が支払う一時金
・開発マイルストン:開発の一定の進捗を契機として導入側が支払う一時金
・販売マイルストン:導入側乃至そのサブライセンス先等の、一定の製品販売金額への到達を契機として、導入側が支払う一時金
・ロイヤリティ :導入側乃至そのサブライセンス先等の製品販売金額等に応じて導入側が支払う使用料
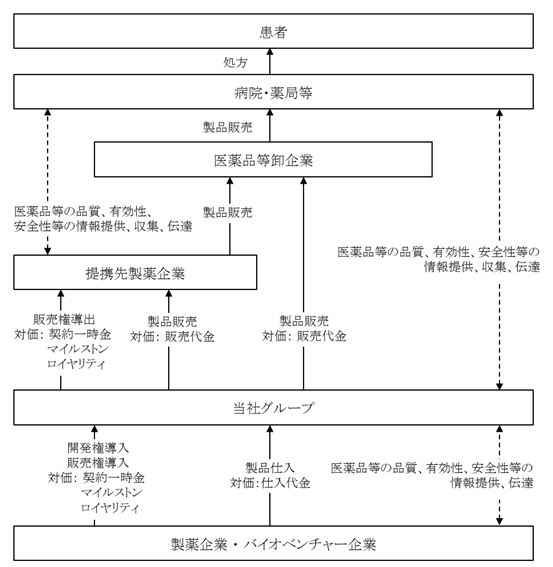
(1) 当社グループの事業領域
現在、日本では悪性腫瘍(一般に悪性新生物又はがんという。以下同じ)が死因の第一位を占めており、中国及びその他のアジア諸国でも死因の上位を占める傾向にあります。当社グループは、悪性腫瘍治療を目的とする医薬品の開発及び販売を主たる事業領域としています。また、悪性腫瘍治療薬の投与や放射線治療によって生じる有害事象(副作用等)を軽減し、悪性腫瘍に対する治療及び患者のクオリティ・オブ・ライフ(QOL)向上が期待できる医薬品及び医療機器の開発及び販売も事業領域としています。
(2) 製薬バリュー・チェーン(初期研究活動から事業化までの機能連鎖)での位置づけ
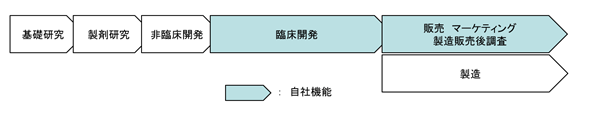
標準的な製薬バリュー・チェーンは、上流の基礎研究、製剤研究、非臨床開発の各機能、中流の臨床開発機能、下流の販売、マーケティング、製造販売後調査※、製造の各機能により構成されます。当社グループは上流機能を持たず、中流以降の各機能に特化した事業を推進しています。なお、現在は、製造機能の全部及び販売機能の一部を保有しておらず、販売機能は中国の主要都市(北京市、上海市、広州市)に対するもののみ保有しています。
また、当社中国子会社では、開発が完了し、現在中国当局に承認申請中である医薬品又は医療機器が当局による承認を得た後、主要都市(北京市、上海市、広州市)において、バリュー・チェーンの下流に位置する販売、マーケティング、販売後調査等、すなわち医薬品等の品質、有効性、安全性等の情報提供、収集及び伝達を自社で行い得る体制の構築を進めています。
※ 製造販売後調査:医薬品の製造販売後の調査及び試験の実施の基準に関する省令において、医薬品の製造販売業者又は外国製造医薬品等特例承認取得者が、医薬品の品質、有効性及び安全性に関する情報の収集、検出、確認又は検証のために行う使用成績調査又は製造販売後臨床試験をいう。
(3) 事業内容
① 医薬品又は医療機器候補物質(以下、医薬品等候補という。)の権利導入
近年、多くの疾患原因の特定が遺伝子レベルの解析によって行われつつあることに伴い、基礎研究及び製剤研究は、より複雑化又は多様化する傾向にあります。大学や病院等の研究機関による成果、この研究を土台とするベンチャー企業の創薬技術や製剤化技術、あるいは国際的な大手製薬企業による研究を通じて、多くの医薬品等候補が産み出されています。当社グループは、一定の開発段階に至った医薬品等候補の権利を導入し、日本や中国等で臨床開発等を通じて当該医薬品等候補を販売可能な状況に導き、これの販売又は導出を通じて収益を得る事業を行っています。基礎研究や製剤技術の他社への提供による収益化を行うものではありません。
当社グループでは、臨床試験開始直前から第Ⅰ相臨床試験※終了までの臨床早期ステージ、又は有効性のproof of concept※が確認される第Ⅱ相臨床試験※から承認までの臨床後期ステージにある医薬品等候補を導入検討の対象としています。また、基礎研究、製剤研究、非臨床開発等の進捗状況の観点からは、少なくとも当社グループの主たる事業エリアである日本及びアジア諸国において科学面及び薬事行政面でも臨床開発が実施可能なレベルで基礎情報が整備されていることを導入の要件としています。
当社グループは、上記要件を満たす医薬品等候補について、当該医薬品等候補が対象とする適応症、非臨床・臨床データ、市場規模、競合品の開発及び販売状況等を検討し、経済条件及び特許権等の知的財産の扱い等について契約相手方と合意を得られた後、導入を決定しています。
※ 第Ⅰ相臨床試験:実施する国において初めて対象となる医薬品候補品(治験薬)を使用する臨床試験で、健康成人がボランティアとして参加することが多い。第Ⅰ相臨床試験の主たる目的は、治験薬の安全性並びに忍容性(薬剤投与によって発現する副作用について、患者が治療を継続できる許容程度)の評価・確認及び薬物動態(生体に投与した薬物の体内動態)の検討である。
※ proof of concept:医療の領域においては、期待あるいは想定される作用(一般には有効性)を初期臨床試験において確認すること。
※ 第Ⅱ相臨床試験:対象となる疾病に罹患している少数の患者群に対し、医薬品候補品を投与して、その有効性及び安全性(副作用の発現等)の予備的評価、将来の実際の臨床現場で使用する投与量や用法の評価を主たる目的とした臨床試験。
② 医薬品等候補の開発
当社グループは、医薬品等候補の導入後、自社の臨床開発機能を中心として、日本を含むアジア各地域の外部委託機関(開発業務受託機関等)と開発チームを構成し、アジア各地域における臨床試験(当該国の製造販売承認に必要な一部の追加非臨床試験を含む)又はアジア各地域を中心とした国際共同治験※を計画し、実施します。
医薬品等候補開発の最終的な目標は、質の高い医薬品等を、早期に医療現場に提供することにあります。そのためには、有望な医薬品等候補の将来性及び可能性を活かして厳格な臨床試験を効率的に計画・実施し、不要な失敗を回避して成功確率を高めることが重要であると考えています。これらを実現するための当社グループにおける医薬品等の開発体制は以下のとおりです。
※ 国際共同治験:共通の実施計画書に基づき、複数の国が参加して実施される臨床試験。
a 当社グループの開発機能
医薬品等開発、臨床試験は、対象となる治療領域における問題点や改善点の評価、具体的な対象疾患及び患者の選択、最適投与量や用法の設計、有効性の評価項目の設定等の試験計画に始まり、実施に当たっては、対象疾患の専門医の選択と当該医師との臨床試験内容の協議、臨床試験実施地域や実施医療施設の評価と選択の過程を経て、実際の投薬及び試験モニタリング、さらに有効性と安全性のデータの収集、解析、評価等の複雑かつ多くのプロセスと諸活動により構成されます。
これらの医薬品等開発のプロセスは、薬事行政規制等に基づいて進められるとともに、常にデータや理論に基づく科学的判断が求められることから、最適な判断のためには、医薬品等や臨床開発全般に対する科学的見識と経験の裏付けが必要不可欠です。当社グループの開発部門は、採用に際してこれらの要素を最重要視して選考を行っており、悪性腫瘍治療薬の臨床開発について、国際的製薬企業等における経験を有する人材、日本国内や中国をはじめとするアジア諸国、さらには国際共同治験の経験を有する人材、あるいは薬事面では各規制当局と密な情報交換が可能な人材等を中心として構成し、少人数であっても医薬品等開発諸活動を円滑に支障なく運営し得る開発体制を構築することに努めています。
b 開発における外部機関の活用
近年、製薬企業における臨床試験実施は、その一部を外部委託機関(Contract Research Organization:CRO※)に外注する傾向にあります。当社グループの開発部門は、臨床開発計画、試験設計、運営、評価及び医薬品等開発に関わる薬事行政対応を基本機能としており、試験実施に際しては、業務効率の向上並びに固定費削減を図るため、この外部委託機関(開発業務委託機関等)等を活用しています。これら外部委託機関の活用においては、当社グループが指示する臨床試験の方針や計画・設計を、正確に理解し実現し得る外部機関を選定することが重要です。そして外部委託機関が計画どおりの成果を果たすために、双方向で詳細な最新情報を共有するとともに、当社グループが随時指示の徹底を図り、管理監督の厳格な実施に努めています。
※ Contract Research Organization, CRO:医薬品等開発の一部の工程を依頼者との契約を以て受託し、実施する企業又はグループの総称。
③ 医薬品等候補の収益化
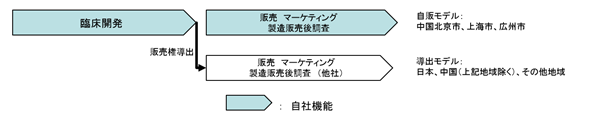
当社グループが医薬品等候補の開発に成功し、上市することとなった場合には、自社販売により収益を得る方法(以下、自販モデルという。)、他社への販売権の導出によって収益を得る方法(以下、導出モデルという。)を選択して、事業化を図ることとなります。現在は、中国の主要都市(北京市、上海市、広州市)では自販モデルを、日本を含むその他の地域では導出モデルを採用しています。
a 自販モデル
医薬品等を、当社グループが採用した医薬情報担当者※の営業活動を通じて販売し、収益を得る方法です。小規模の販売体制で市場をカバーし得る限られた中国主要都市(北京市、上海市、広州市)において、自販モデルの採用を計画しています。また、中国の医薬品市場は、2020年には米国に次ぐ世界第二位の規模に成長することが期待されていますが、中国市場で成功するためには当社グループ及び当社グループ製品のブランドイメージの確立を目指したマーケティング活動を自社で行うことが重要であると考えています。そのために、主要都市(北京市、上海市、広州市)のみならず、販売提携先とともに中国全土のマーケティング活動を行うことを計画しています。
※ 医薬情報担当者(Medical Representative:MR):医薬品の適正使用のため医療従事者を訪問すること等により、医薬品の品質、有効性、安全性などに関する情報の提供、収集、伝達を主な業務として行う者。
b 導出モデル
当該医薬品等の対象となる疾患領域で販売実績を有する製薬企業に販売権を導出することにより、収益を得る方法です。契約一時金、マイルストン収入及びロイヤリティ収入による収益の確保を図ります。
(4) 当社グループの開発パイプライン
① Sancuso®(経皮吸収型グラニセトロン製剤:開発コードSP-01(医薬品))
a がん化学療法剤投与に伴う悪心・嘔吐
悪心・嘔吐は、がん化学療法剤の投与を受ける多くの患者が苦痛を感じる副作用の1つであり、急性(投与後24時間まで)と遅延性(投与後24時間以降)に分類されます。悪心・嘔吐が十分にコントロールされない場合、脱水、電解質異常※、栄養障害、誤嚥性肺炎等の生命を脅かしかねない多くの合併症を来す可能性があります。このような合併症が起こることによる入院期間の延長、看護に要する時間の延長、薬剤投与を含む全般的な医療コストの増大等、悪心・嘔吐は、患者のみならず、様々な影響を及ぼすことが想定されます。催吐作用(吐き気を催す作用)の強い一部のがん化学療法剤では9割以上の患者に悪心・嘔吐が生じることがあります。悪心・嘔吐による苦痛は時間とともに増大することが多く、悪心・嘔吐をコントロールすることができない場合には、がん化学療法のコンプライアンス(推奨される悪性腫瘍治療薬の用法用量、その他投薬ルールの順守状況)の低下が懸念されます。
がん化学療法剤投与に伴う悪心・嘔吐の発現メカニズムの1つは、化学受容器引金帯※(Chemoreceptor Trigger Zone:CTZ)の活性化によるとされ、CTZの活性化は、ドパミン、オピオイド、ヒスタミン、アセチルコリン、ニューロキニン-1(Neurokinin-1:NK-1)又は5-ヒドロキシトリプタミン3型(5-hydroxytryptamine3:5-HT3)受容体※等に対する刺激によって直接的又は間接的に引き起こされると考えられています。また、がん化学療法剤による消化管粘膜の損傷や消化管の神経伝達細胞受容体の刺激、及び皮質や前庭※のメカニズムも関与していると考えられています。
※ 電解質異常:体内のナトリウムやカリウム、マグネシウム等の電解質が異常な状態となり、浸透圧調整や筋肉収縮の機能に異常をきたすこと。
※ 化学受容器引金帯:第4脳室に接する脳幹領域に存在する受容器。血中のある種の薬物や毒物に反応して嘔吐中枢に刺激を送り、嘔吐を誘発する。
※ 5-ヒドロキシトリプタミン3型(5-hydroxytryptamine3:5-HT3)受容体:イオン共役型のセロトニン受容体で、中枢神経系、末梢神経系に作用して、神経興奮、不安、嘔吐を誘発する。
※ 前庭:内耳にあり重力と直線加速度を司る感覚器官。
b 5-HT3受容体拮抗薬
各種悪性腫瘍の臨床ガイドラインにおいて、がん化学療法剤投与に伴う悪心・嘔吐に対して5-HT3受容体拮抗薬※の使用が推奨されています。グラニセトロンは5-HT3受容体拮抗薬の1つで、5-HT3受容体への結合によるセロトニン刺激の遮断によってがん化学療法剤投与に伴う悪心・嘔吐を予防する作用があります。グラニセトロンの経口剤及び注射剤は、これまでに得られた臨床試験の結果から、がん化学療法剤投与に伴う悪心・嘔吐の予防に極めて有効であることが確認されており、既に世界各国で承認されています。
※ 受容体拮抗薬:生体内の受容体分子に働いて神経伝達物質やホルモン等の働きを阻害する薬のこと。
c SP-01開発の経緯
SP-01は、粘着基剤※中にグラニセトロンを含有する経皮吸収型製剤※です。貼付後から持続的にグラニセトロンを放出するよう設計されており、5日間にわたって安定的に血中グラニセトロン濃度を維持することが可能な医薬品です。SP-01を一旦貼付すれば、5日間は新たな制吐剤投与のために来院する必要がなく、外来治療の負担の軽減が期待できます。また、がん化学療法剤を投与中の患者が、悪心・嘔吐や口内炎が原因で薬剤の服用が困難な状態にある場合、経口剤や注射剤と比較し、経皮吸収型製剤は有用と考えられ、医療現場における投薬業務を簡便化することが可能と考えています。経皮吸収型グラニセトロン製剤は、米国を代表するがんセンターで結成されたガイドライン策定組織(National Comprehensive Cancer Network:NCCN)が作成したNCCN診療ガイドラインにおいても処方が推奨されています。また、中国においては、2014年にがん治療ガイドライン策定グループが作成した治療ガイドラインにおいても同様に処方が推奨されています。
(図:SP-01 Sancuso®の貼付)
SP-01は、米国において「高度※又は中等度催吐性※がん化学療法剤の最長5日間投与に伴う悪心・嘔吐の予防」を適応として2008年9月に米国食品医薬品局から承認されています(販売名:Sancuso®)。また、米国以外では、欧州の主要国(英国、ドイツ、オランダ、デンマーク、スペイン)、北欧諸国(フィンランド、ノルウェー、スウェーデン)、中東諸国(クウェート、レバノン、カタール、バーレーン、アラブ首長国連邦、リビア、サウジアラビア)及びアジア諸国(韓国、台湾、香港、シンガポール、マカオ、フィリピン、クウェート、オーストラリア)で販売又は承認(承認勧告含む)されています。
当社グループは、2008年5月の本剤導入後から臨床開発を推進してまいりました。2008年に日本人での薬物動態試験※、2012年に韓国人での薬物動態試験をそれぞれ実施した他、2013年から2014年に亘り中国人での薬物動態試験及び中国人がん患者での無作為化二重盲検比較試験※を実施し、2014年6月に中国において新薬承認申請を完了し、本書提出日現在、中国規制当局による審査が行われています。
※ 粘着基材:皮膚に接着する粘着剤で、SP-01は粘着基材がフィルム状シートに塗布されている。
※ 経皮吸収型製剤:医薬品の有効成分が皮膚を通して体内に吸収されるよう設計された剤型。
※ 高度催吐性:90%を超える患者に催吐が生じること。
※ 中等度催吐性:30~90%の患者に催吐が生じること。
※ 薬物動態試験:医薬品の体内における動き、蓄積などを評価する臨床試験。
※ 無作為化二重盲検比較試験:評価の対象となる医薬品候補と標準的薬剤を無作為に割り付け、医師及び患者のいずれもがどちらの薬剤を使用しているかわからない状態で治療及び評価を行う試験手法で、結果に対するバイアスを排除した客観的な評価を行うことができる。
d SP-01の主要な臨床試験概要
試験相: 第Ⅲ相臨床試験(欧米での承認取得のための最終試験)
被験者: 637名、中等度又は高度催吐性のがん化学療法剤で複数日治療を受けた欧米のがん患者
目的: 悪心・嘔吐の予防に対するSP-01の有効性の検証及び安全性の確認
成績: 有効性については、グラニセトロン経口剤に対するSP-01の非劣性※を確認。
安全性については、SP-01投与群とグラニセトロン経口剤投与群で被験薬との関連性が否定できない有害事象※の発現率に大きな差は認められないことを確認。
試験実施:ProStrakan Group plc 試験完了:2006年
試験相: 第Ⅲ相臨床試験(中国での承認取得のための最終試験)
被験者: 313名、中等度又は高度催吐性のがん化学療法剤で複数日治療を受けた中国人がん患者
目的: 悪心・嘔吐の予防に対するSP-01の有効性の検証及び安全性の確認
成績: 有効性については、グラニセトロン経口剤に対するSP-01の非劣性を確認。
安全性については、SP-01投与群とグラニセトロン経口剤投与群で被験薬との関連性が否定できない有害事象の発現率に大きな差は認められないことを確認。
試験実施:当社 試験完了:2014年
※ 非劣性:第Ⅲ相臨床試験における有効性検証の手法の1つで、試験薬が対照薬に対して劣らないことを指す。
※ 有害事象:臨床試験の実施期間中に起こる治験薬又は製造販売後臨床試験薬を投与された被験者に生じたすべての好ましくない又は意図しない疾病又はその徴候をいう。当該治験薬又は当該製造販売後臨床試験薬との因果関係の有無は問わない。
e SP-01の収益化戦略
中国主要都市(北京市、上海市、広州市)では、自販モデルにより収益化を図ります。当社中国子会社においてマーケティング体制及び販売体制を構築のうえ運営し、医薬品卸業者等を活用し、製品販売を行う計画です。また、主要都市以外の中国市場に対しては、導出モデルにより収益化を図ります。2015年11月にLee's Pharmaceutical (HK) Limitedと締結した「Sancuso® License, Promotional and Supply Agreement」(販売権導出契約)のもと、同社によるマーケティングや販売活動を通じて、収益を得る計画です。本書提出日現在、導出モデル上の契約金収入は過年度に収益計上していますが、SP-01は中国当局による審査中であり、当局による新薬承認を受け次第、上記収益化計画を具体化していく方針です。
台湾、香港、シンガポール、マレーシア及びマカオ市場に対しては、導出モデルにより収益化を図ります。2010年2月及び2014年9月に協和発酵キリン株式会社と締結した「EXCLUSIVE LICENSE AND SUPPLY AGREEMENT」(販売権導出契約)のもと、同社によるマーケティング・販売活動を通じて、収益化を図る計画です。本書提出日現在、当該地域のうち、台湾、香港、シンガポール、マカオでは、既に当局による新薬承認を受けており、一部マイルストン収入による収益を計上しています。マレーシアでは規制当局による承認申請を完了し、新薬承認を待機している状況です。
② darinaparsin(ミトコンドリア標的アポトーシス誘導剤:開発コードSP-02(医薬品))
a 末梢性T細胞リンパ腫※
当社は、海外で実施された臨床試験結果から、末梢性T細胞リンパ腫(Peripheral T-Cell Lymphoma:PTCL)をSP-02の最初の適応症※と選択し、当該適応症に対する開発を行っています。末梢性T細胞リンパ腫は、非ホジキンリンパ腫※の一病型です。一般的に末梢性T細胞リンパ腫という場合、胸腺※での細胞分化※と成熟を経て末梢臓器※に移動したT細胞※に起源を発するリンパ腫の総称で、主に以下の病型に分類されます。
・末梢性T細胞リンパ腫-非特異群※:PTCL-NOS
・血管免疫芽球型T細胞リンパ腫※:AITL
・ALK※陽性未分化大細胞型リンパ腫※:ALCL ALK+
・ALK陰性未分化大細胞型リンパ腫:ALCL ALK-
末梢性T細胞リンパ腫を含むT細胞リンパ腫は、B細胞リンパ腫※に比べて予後不良で、International T-Cell Lymphoma Project※で行った研究によると、PTCL-NOS及びAITLの5年全生存率※はともに32%であり、ALK陽性ALCLは70%、ALK陰性ALCLは49%と報告されています。
※ リンパ腫:血液がんの一種で、白血球の中のリンパ球ががん化したものをいう。
※ 末梢性T細胞リンパ腫:白血球の中のTリンパ球ががん化した悪性腫瘍で、リンパ腫の約10%を占める非ホジキンT細胞性リンパ腫。病因は不明で標準的治療法は確立されていない。
※ 適応症:薬剤の治療の対象となる疾病をいう。
※ 非ホジキンリンパ腫:ホジキンリンパ腫以外のすべての多様な悪性リンパ腫を含む一群。ホジキンリンパ腫とは腫瘍細胞の性状や形態の違いなど、いわゆる病理組織学的所見をもとに組織分類される。
※ 胸腺:胸骨の裏側、心臓の上前部(前縦隔:ぜんじゅうかく)にあり、Tリンパ球と呼ばれる白血球をつくっている臓器。
※ 細胞分化:細胞が特定の機能を有する細胞に変化するプロセス。
※ 末梢臓器:末梢は中枢に対する対義語で、神経系における「脳・脊髄」に対する末梢神経や効果器・感覚器等を指す。
※ T細胞:リンパ球の一種で、骨髄で産生された前駆細胞が胸腺での選択を経て分化し成熟したもの。細胞表面に特徴的なT細胞受容体を有している。末梢血中のリンパ球の70〜80%を占める。
※ 末梢性T細胞リンパ腫-非特異群:悪性リンパ腫のWHO分類(2008)において成熟T細胞及びNK細胞腫瘍に分類されるリンパ腫の一型。
※ 血管免疫芽球型T細胞リンパ腫:悪性リンパ腫のWHO分類(2008)において成熟T細胞及びNK細胞腫瘍に分類されるリンパ腫の一型。
※ ALK(anaplastic lymphoma kinase):未分化リンパ腫リン酸化酵素と呼ばれる受容体型チロシンキナーゼ。ALK陽性とはALKを含むことをいい、ALK陰性とはALKを含まないことをいう。
※ 未分化大細胞型リンパ腫:悪性リンパ腫のWHO分類(2008)において成熟T細胞及びNK細胞腫瘍に分類されるリンパ腫の一型。
※ B細胞リンパ腫:非ホジキンリンパ腫の一種であり、リンパ球の一種であるB細胞ががん化した悪性腫瘍。
※ International T-Cell Lymphoma Project:国際的なT細胞リンパ腫の調査プロジェクト。
※ 5年全生存率:診断あるいは治療開始から5年間経過後に生存している人の割合のこと。
b 治療法及び予後
現在まで、日本国内において、病型(病理組織学的分類)を問わず「悪性リンパ腫」の効能を有する医薬品(抗悪性腫瘍薬及び副腎皮質ステロイド薬※)は多数存在しますが、PTCLの効能を有する医薬品はありません。PTCLに対する治療に医薬品が単剤で使用されることは稀で、通常は複数の医薬品を組み合わせた多剤併用療法が行われています。
悪性リンパ腫に対する診療ガイドラインは、米国のNCCN、欧州臨床腫瘍学会(European Society for Medical Oncology:ESMO)、英国血液学会(British Committee for Standards in Hematology:BCSH)及び国内の日本血液学会等により各々公表されていますが、いずれのガイドラインにおいても、PTCLの初回治療※は、一番目に「臨床試験への参加」が挙げられた上で、CHOP療法※やその類似療法であるCHOEP療法※及びHyper CVAD/MA療法※等のアントラサイクリン系抗悪性腫瘍薬※ を含む多剤併用療法が挙げられています。
PTCLは患者数が限定されているため、これまでびまん性大細胞型B細胞リンパ腫※(Diffuse Large B Cell Lymphoma:DLBCL)等を含むアグレッシブ・リンパ腫※の臨床試験に含めて解析されており、PTCLに限定した大規模な臨床試験は行われていません。そのため、アグレッシブ・リンパ腫に対する初回治療として、CHOP療法が標準治療に位置付けられたことを受け、DLBCLと同様、PTCLに対してもCHOP療法が選択されています。
一方、再発・難治例に対する救援療法※については、上述の診療ガイドラインのいずれにおいても「臨床試験への参加」が推奨されていて、「臨床試験への参加」以外の治療選択肢として、DHAP療法※、ESHAP療法※、GDP療法※、GemOx療法※、ICE療法※、MINE療法※等が列挙されています。また、日本ではこれらの療法に加え、CHASE療法※、EPOCH療法※、DeVIC療法※等が行われる場合もありますが、いずれの多剤併用療法も医学的知見(臨床データの蓄積等)は未だ乏しい状況と考えられています。
以上のとおり、PTCLの初回治療に明確な医学的知見は存在しておらず、CHOP療法に代表されるアントラサイクリン系抗悪性腫瘍薬を含む多剤併用療法が日常診療で広く行われているものの、治療成績は十分ではないのが現状です。再発・難治例においては、確立された救援療法がなく、予後は不良であり、悪性リンパ腫の治療では、多剤併用療法が有効であると考えられていることから、これまでに多くの組み合わせが検討され、その一部が日常診療で使用されています。
これらの治療現状から、より治療成績の高い併用療法の組み合わせに加えられるような、忍容性が良好で、かつ従来の抗悪性腫瘍薬と異なる作用機序※を有する新たな治療薬が望まれています。
※ 副腎皮質ステロイド薬:抗炎症作用や免疫抑制作用が期待される薬剤の一種。造血器腫瘍への適用が認められている薬剤が存在する。
※ 初回治療:ある患者が最初に施される化学療法をいう。
※ CHOP療法:シクロホスファミド、ドキソルビシン、ビンクリスチン、ステロイドで構成される併用療法の1つ。
※ CHOEP療法:シクロホスファミド、ドキソルビシン、ビンクリスチン、エトポシド、プレドニゾロンで構成される併用療法の1つ。
※ Hyper CVAD/MA療法:シクロホスファミド、ドキソルビシン、ビンクリスチン、デキサメタゾン、メトトレキセート、シタラビンで構成される併用療法の1つ。
※ アントラサイクリン系抗悪性腫瘍薬:がん治療に使用される抗生物質の薬剤。
※ びまん性大細胞型B細胞リンパ腫:悪性リンパ腫の種類の1つで、Bリンパ球細胞から発生する非ホジキンリンパ腫で中悪性度に分類される。日本の非ホジキンリンパ腫の30~40%を占めており、最も発生頻度の高い病型。
※ アグレッシブ・リンパ腫:Working Formulation分類では、病型分類の他に非ホジキンリンパ腫の進行速度に基づき、無治療での予後が年単位で進行する低悪性度,月単位で進行する中悪性度、週単位で進行する高悪性度というように悪性度による分類がなされ、アメリカのNational Cancer Instituteより、悪性度による分類に加えて疾患の悪性度、活動性や侵攻性といったaggressivenessの程度を考慮した、低悪性度=インドレントリンパ腫(indolent lymphoma)、中悪性度=アグレッシブ・リンパ腫(aggressive lymphoma)、高悪性度=高度アグレッシブ・リンパ腫(highly aggressive lymphoma)という臨床分類が提唱されている。
※ 救援療法:主に造血器腫瘍において、治療効果が得られない場合(治療抵抗性)、あるいは再発・再燃した場合に用いる治療を、救援療法あるいは救援化学療法と呼ぶ。がんの種類によって治療内容は異なり、複数の薬(抗がん剤など)を組み合わせた治療が主流で、救済療法又はサルベージ療法と呼ばれることもある。
※ DHAP療法:デキサメタゾン、シスプラチン、シタラビンで構成される併用療法の1つ。
※ ESHAP療法:エトポシド、メチルプレドニゾロン、シタラビン、シスプラチンで構成される併用療法の1つ。
※ GDP療法:ゲムシタビン、デキサメタゾン、シスプラチンで構成される併用療法の1つ。
※ GemOx療法:ゲムシタビン、オキサリプラチンで構成される併用療法の1つ。
※ ICE療法:イホスファミド、カルボプラチン、エトポシドで構成される併用療法の1つ。
※ MINE療法:メスナ、イホスファミド、ミトキサントロン、エトポシドで構成される併用療法の1つ。
※ CHASE療法:シクロホスファミド、エトポシド、シタラビン、デキサメタゾンで構成される併用療法の1つ。
※ EPOCH療法:エトポシド、ドキソルビシン、ビンクリスチン、シクロホスファミド、プレドニゾロンで構成される併用療法の1つ。
※ DeVIC療法:カルボプラチン、イホスファミド、エトポシド、デキサメタゾンで構成される併用療法の1つ。
※ 作用機序:薬剤がその効果を発揮するための特異的な生化学的相互作用をいう。
c SP-02開発の経緯
SP-02は、有機ヒ素※化合物を製剤化した医薬品候補で、PTCLに対する以下の新しい作用機序により、最終的な殺細胞効果を発現すると考えられています。
・腫瘍細胞内ミトコンドリア※への直接的な傷害
・腫瘍細胞内のROS(Reactive Oxygen Substance※)を増加させることによる細胞傷害※の誘発
・カスペース※9、カスペース3を介してのアポトーシス※誘導
これまでに実施された薬効薬理試験※結果から、無機ヒ素化合物である三酸化ヒ素※(Arsenic trioxide:ATO)に比してSP-02は細胞内取り込み濃度が高く、白血病、骨髄腫、悪性リンパ腫、固形腫瘍の各細胞株※に対するin vitro※活性が示され、また造血器腫瘍に対する抗腫瘍効果、及び固形腫瘍細胞株に対する殺細胞作用が認められています。さらに、SP-02の細胞毒性※はATOと異なり、PML/RARα融合蛋白※と無関係に発現し、ATO耐性細胞株※に対しても殺細胞作用が確認されています。
SP-02は、生体内でのヒ素を解毒する経路で生じる中間代謝体※と同じ構造を持ち、グルタチオン抱合体※構造を有することから、無機ヒ素化合物より毒性が低く、治療域がより広くなることが期待されます。
多剤併用療法で使用頻度の高いアントラサイクリン系抗悪性腫瘍薬の心毒性※は広く認識されていますが、SP-02は、第Ⅰ相臨床試験で実施された詳細な心電図評価において、ATOで報告されている不整脈や心電図異常(QT延長※)等の心毒性は認められず、将来アントラサイクリン系抗悪性腫瘍薬を含む多剤併用療法と安全に組み合わせられる可能性があります。
また、上記のとおり、SP-02は分子標的薬ではなく、その適用範囲や作用機序は多岐に渡ることが想定されていることから、今後PTCL以外の血液がん又は固形がんに対する適応の拡大が期待されています。
なお、SP-02は米国及び欧州において、PTCL治療薬として、希少疾病用医薬品※(オーファン・ドラッグ)に指定されています。
本剤は、導入元であるZIOPHARM Oncology, Inc.により開発が進められてきており、同社により、米国及びインドでの前期第Ⅱ相臨床試験が2012年に完了されています。当社グループは、2011年3月の本剤導入後から臨床開発を推進してまいりました。2015年に、日本及び韓国での第Ⅰ相臨床試験を完了しています。2016年に、承認申請への最終試験としての設計のもと、日本、韓国、台湾及び香港での国際共同治験第Ⅱ相臨床試験を開始しており、本書提出日現在も当該試験を実施中です。
※ 有機ヒ素:炭素を含むヒ素化合物。
※ ミトコンドリア:ほとんどの真核生物に存在する細胞小器官で、独自のDNAを持ち、分裂・増殖する。好気呼吸によりエネルギーを生み出す器官。
※ Reactive Oxygen Substance, ROS:活性酸素種ともいう。活性酸素種は好気性生物が酸素を消費する過程で発生する反応性の高い副産物であり、細胞内のDNAを損傷するとされている。
※ 細胞傷害:細胞に対して死、若しくは機能障害や増殖阻害の影響を与える、物質や物理作用等の性質。
※ カスペース:細胞にプログラム細胞死を起こさせるシグナル伝達経路を構成するシステインプロテアーゼ。カスペース3やカスペース9はその一種。
※ アポトーシス:細胞に組み込まれたプログラムによる細胞死。
※ 薬効薬理試験:医薬品等の作用(効果)評価を目的とした細胞、組織あるいは動物などを用いた試験。
※ 三酸化ヒ素:無機ヒ素化合物の1つで、日本では再発又は難治性の急性前骨髄球性白血病を適応症として承認されている(トリセノックス®)。
※ 細胞株:長期間にわたって体外で維持され、一定の安定した性質をもつに至った細胞をいう。
※ in vitro:試験管や培養器内等の人工的に構成管理された試験条件及び環境。
※ 細胞毒性:細胞傷害性のこと。
※ PML/RARα融合蛋白:急性前骨髄球性白血病では、第15番染色体の一部と第17番染色体の一部が切れて互いに入れ代わる相互転座が起こり、その際に第17番染色体にあるレチノイン酸受容体α遺伝子(RARα)が第15番染色体にあるPML遺伝子のもとに移動し、PML/RARα融合遺伝子が作られる。この融合遺伝子が作るPML/RARα蛋白は、RARα遺伝子とPML遺伝子から作られる蛋白がもともと持っている白血球の分化・成熟作用を阻止し、その結果、急性前骨髄球性白血病では、前骨髄球の段階で細胞の分化・成熟が停止し、前骨髄球が異常に増える白血病が発症する。
※ ATO耐性細胞株:三酸化ヒ素(無機ヒ素化合物)に耐性を有する細胞株。
※ 中間代謝体:体内の代謝での物質変化は、多くの中間段階を経て行われるのが常であり、終産物に行きつく手前のこれらの中間段階の物質をいう。
※ グルタチオン抱合体:生体内に取り込まれた生体外物質を無毒化し体外へ排出する代謝過程において活性化された生体外物質の代謝物は、グルタチオン等の電荷を持つ化学種に抱合される(グルタチオン抱合体)。
※ 心毒性:心臓に機能低下・異常あるいは病変等の悪影響を及ぼすこと。
※ QT延長:心電図上のQT時間の延長で、心筋細胞の電気的な回復が延長することにより起こる。
※ 希少疾病用医薬品:「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(以下、医薬品医療機器等法という。)第77条の2に基づき、厚生労働大臣によって指定されるもので、対象患者数は日本で5万人未満、医療上特にその必要性が高いもの、実質的な開発計画があるもの等が対象となる。優先審査や開発に際しての補助金等のメリットがある。
d SP-02の主要な臨床試験概要
試験相: 前期第Ⅱ相臨床試験※
被験者: 50症例、各種造血器腫瘍(悪性リンパ腫、白血病等)患者(米国及びインド)
目的: SP-02の有効性、安全性、薬物動態の評価
成績: 悪性リンパ腫、特にPTCLについて抗腫瘍効果が示唆された。
試験実施:ZIOPHARM Oncology, Inc.(当社導入元) 試験完了:2012年
試験相: 第Ⅰ相臨床試験
被験者: 23症例、PTCL患者(日本及び韓国)
目的: SP-02の安全性、忍容性、薬物動態、有効性の評価
成績: 試験実施計画書に則った臨床推奨用量※及び投与スケジュールにおける安全性及び忍容性が確認された。有効性解析対象例は14例で、一部の症例で抗腫瘍効果が示唆された。日本及び韓国の統合解析結果を下記ウォーターフォール図に示した。
試験実施:当社 試験完了:2015年
※ 前期第Ⅱ相臨床試験:第Ⅱ相臨床試験のうち、探索的な試験をいう。
※ 臨床推奨用量:臨床の現場を想定して、推奨される薬剤の用量。
SP-02第Ⅰ相臨床試験の有効性解析(ウォーターフォール図)
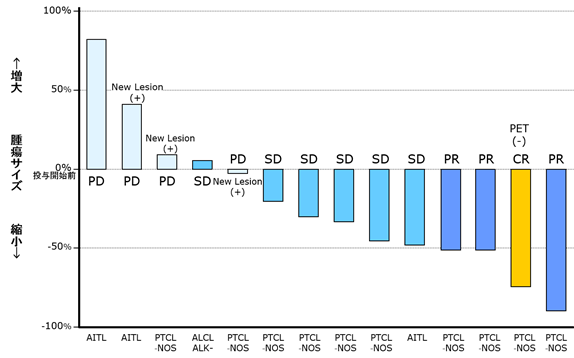
※ 上図は、末梢性T細胞リンパ腫患者に対するSP-02投与開始前と最良有効性評価時点(評価期間中での、薬剤の治療効果が最も高まったタイミング)、コンピューター断層撮影(CT)検査による腫瘍効果判定の結果を示す。棒グラフの各棒の長さが各被験者の腫瘍サイズの増減率を示し、何れも投与開始前を0%とし、例えば+80%を示す場合は腫瘍サイズが最良有効性評価時点で投与開始時点から80%増大したことを示し、-80%を示す場合は当該サイズが80%縮小したことを示す。なお、腫瘍サイズは各標的病変(測定の対象となる腫瘍病変)の二方向の直径の積の総和の変化によって測定される。
※ 横軸の下の略語は、有効性解析対象となった各被験者の末梢性T細胞リンパ腫の以下病型分類を示す。全生存率出所は前掲のとおり。
・AITL:血管免疫芽球型T細胞リンパ腫(5年全生存率32%)
・PTCL-NOS:末梢性T細胞リンパ腫-非特異群(5年全生存率32%)
・ALCL ALK-:ALK陰性未分化大細胞型リンパ腫(5年全生存率49%)
※ 各棒に付してある略語は、フルオロデオキシグルコースを用いたポジトロン断層撮影(Fluorodeoxyglucose-Positron Emission Tomography:FDG-PET)検査を加味した効果判定規準(改訂版悪性リンパ腫の効果判定規準,出典:造血器腫瘍取扱い規約第1版)における腫瘍縮小効果判定(下表)に基づく。
|
総合 効果 |
標的病変の二方向積和 |
非標的病変 |
骨髄浸潤 |
PET |
新病変 |
||
|
節性 |
節外性 |
節性 |
節外性 |
||||
|
CR |
二方向積和の変化は問わない(未検は不可) |
陰性 |
陰性 |
なし |
|||
|
PR |
二方向積和の変化は問わない(未検は不可) |
陰性 |
陰性 |
なし |
|||
|
50%以上縮小 |
正常又は非増大 |
消失又は非増大 |
問わない(未検可) |
陽性 |
なし |
||
|
SD |
50%未満の縮小かつ 50%未満の増大 |
正常又は非増大 |
消失又は非増大 |
問わない(未検可) |
陽性 |
なし |
|
|
PD |
50%以上増大 |
増大 |
増大 |
陽性化 |
陽性 |
あり |
|
|
RD |
再腫大 |
再出現 |
再腫大 |
再出現 |
|||
CR:完全奏効(Complete Response) PR:部分奏効(Partial Response)
奏功とは、薬の投与による効果をいう。
SD:安定(Stable Disease) PD:進行(Progressive Disease)RD:再発(Relapsed Disease)
※ 非標的病変:測定の対象以外の腫瘍病変をいう。
※ 骨髄浸潤:腫瘍が骨髄に浸潤する(入り込む)こと。
※ 節性、節外性:節性とは標的病変がリンパ節にある場合をいう。節外性とは標的病変がリンパ節以外の臓器にある場合をいう。
※ 未検可、未検不可:臨床試験に際して当該項目の検査が実施されなくとも、当該効果判定評価が可能な場合を「未検可」という。当該項目の検査が実施されない場合、当該効果判定評価が不可能な場合を「未検不可」という。
※ 再腫大:再発により、腫瘍の大きさが再び増大すること。
※ 再出現:再発により、腫瘍が再び出現すること。
※ 上記第Ⅰ相臨床試験での有効性解析結果は以下のとおり。
・有効性解析対象14例における有効例は4例(CR及びPR)、最良反応(臨床試験計画において予め定められた観察評価期間中に認められた最大効果)率は28.6%(14例中4例)。
・このほか、安定(SD)症例6例のうち5例は腫瘍の縮小が認められた。
e SP-02の収益化戦略
SP-02は導出モデルによる収益化を図ります。なお、日本をはじめ各国の規制当局の承認を受けた上で、導出先が販売を開始することとなります。
日本市場に対しては、2015年1月にMeiji Seika ファルマ株式会社と締結した「ライセンス契約書」(販売権導出契約)のもと、同社による販売活動を通じて、収益化を図ります。
その他、米国、欧州、中国、韓国等の諸市場に対しては、今後、諸地域毎に製薬企業等への導出契約を締結し、当該企業の販売活動を通じて収益化を図ることを計画しており、これらの地域における導出候補先の選定を進めています。
③ episil®(口腔内創傷被覆材料:開発コードSP-03(医療機器))
a がん化学療法剤治療又は放射線治療によって誘発される口腔内粘膜傷害(口内炎)
がん化学療法剤及び放射線治療に伴う口内炎は、化学療法薬剤による作用として、また化学療法や放射線療法による抵抗力の低下による細菌等の感染により発生します。発生頻度は30〜40%程度であり、重症化するとがん治療の継続が困難になることもあります。症状としては、接触痛、出血、冷温水痛※、口腔乾燥、口腔粘膜の発赤※・腫脹※、開口障害※、構音障害※、嚥下障害※、味覚障害などが報告されています。また、がん治療を受ける患者にとって、栄養を十分摂取することが全身状態の改善や口内炎の改善に寄与するため、経口摂取に支障を来さない適切な口腔内管理を行うことが重要と考えられています。
※ 冷温水痛:冷水や温水に対して痛みを感じる状態。
※ 発赤:皮膚や粘膜の一部に炎症がおこり、充血して赤くなる状態。
※ 腫脹:炎症などが原因で、局所の血流量が増加し体の組織や器官の一部が腫れ上がる状態。
※ 開口障害:なんらかの原因で下顎の開口が制限される状態。
※ 構音障害:音を作る器官やその動きに問題があって発音がうまくできない状態。
※ 嚥下障害:食物等を飲み込むことがうまくできない状態。
b 現在の主な治療方法
がん化学療法剤及び放射線治療に伴う口内炎には確立した治療方法はなく、症状にあわせた対症療法が主となります。二次感染の予防や重症化を防ぐために、含嗽(うがい)による口腔内の保清・保湿による口腔ケアを継続し、軽度から中等度の痛みには局所麻酔薬による含嗽に加え、解熱消炎鎮痛薬を使用する場合があります。また、口腔乾燥からの粘膜保護には、保湿剤や唾液の分泌を促す経口薬投与や人工唾液などを補助的に使用します。最近では、コラーゲンの新生促進や血流改善、血管新生を促進する低出力レーザの照射により、疼痛緩和効果をはじめ抗炎症効果、鎮痛効果、創傷治癒促進効果が認められており、口内炎治療に応用されています。
c SP-03開発の経緯
SP-03は、種々のがんに対する化学療法剤治療又は放射線治療によって誘発される口腔内粘膜傷害(口内炎)への外部刺激による疼痛の緩和及び管理を主たる目的として開発されており、感染症予防や疼痛緩和によって食事摂取が可能になることによるクオリティ・オブ・ライフ(QOL)の向上も期待されています。SP-03は、レシチン※及びグリセリン脂肪酸エステル※からなる非吸収性の液体であり、口腔内にごく少量の内容液を滴下塗布(ポンプ容器を用いた塗布)することにより、口腔内で唾液と混合されてごく薄い脂質被膜を構成し、口内炎表面を物理的に覆うことによって、食物等の外部刺激による疼痛を一定時間緩和することが期待されます。薬効成分※は含まれないため、医薬品医療機器等法上は医薬品ではなく、医療機器に分類されます。
本剤は、米国及び欧州の一部の国で製品名episil®として既に承認・販売されており、当社グループは、2015年3月に本剤の日本及び中国の権利を導入した後、中国では2016年5月、日本においては2016年10月に、それぞれの規制当局に対して新医療機器承認申請を完了しています。
※ レシチン:グリセロリン脂質の一種。自然界の動植物においてすべての細胞中に存在しており、生体膜の主要構成成分である。
※ グリセリン脂肪酸エステル:グリセリンの持つ3つのヒドロキシ基のうち1つ乃至2つに脂肪酸がエステル結合したもので、代表的な食品用乳化剤である。
※ 薬効成分:有効成分ともいう。医薬品、医薬部外品などに含有される物質のうち、生理活性を示すものの総称。
d SP-03の主要な臨床試験概要
被験者: 116症例、血液がん患者(造血幹細胞移植の前処置療法として化学療法及び放射線療法を受けた患者)(欧州)
目的: 口腔粘膜炎に対する各施設(病院等)の標準的な処置及びSP-03の併用療法と、標準的な処置のみを実施した場合の有効性及び安全性の確認。
成績: 一定量以上のSP-03を使用した症例(併用療法)では、標準的な処置のみが行われた症例に対して高い有効性が確認された。また、安全性も確認された。
試験実施:Camurus AB (当社導入元) 試験完了:2013年
e SP-03の収益化戦略
日本市場に対しては、導出モデルにより収益化を図ります。2016年11月にMeiji Seika ファルマ株式会社と締結した「ライセンスおよび販売提携契約書」(販売権導出契約)のもと、同社によるマーケティングや販売活動を通じて収益化を図る計画です。
中国主要都市(北京市、上海市、広州市)では、自販モデルにより収益化を図ります。当社中国子会社においてマーケティング体制及び販売体制を構築のうえ運営し、医薬品等卸業者等を活用し、製品販売を行う計画です。また、中国主要都市以外の市場に対しては、導出モデルにより収益化を図ります。2017年2月にLee'sPharmaceutical (HK) Limitedと締結した「episil® LICENSE, PROMOTIONAL AND SUPPLY AGREEMENT」(販売権導出契約)のもと、同社によるマーケティングや販売活動を通じて、収益化を図る計画です。
本書提出日現在、SP-03は日本、中国それぞれ当局による審査中であり、当局による医療機器承認を受け次第、上記収益化計画を具体化していく方針です。
当社グループの開発パイプラインの進捗状況は下記のとおりです(2017年2月現在)。
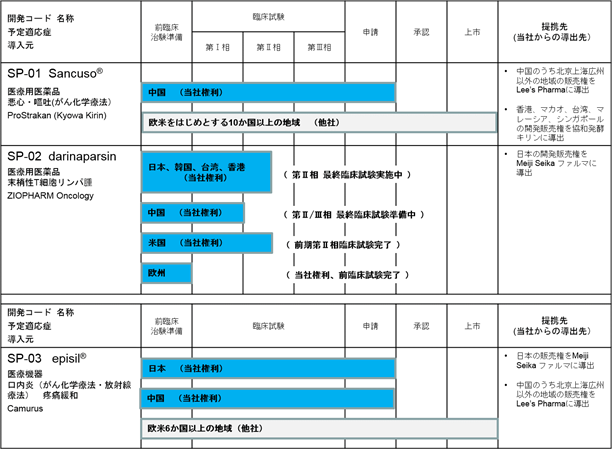
※SP-02の日本、韓国、台湾、香港の第Ⅱ相臨床試験は、承認申請への最終試験として設計され、実施しています。
4【関係会社の状況】
|
名称 |
住所 |
資本金 |
主要な事業の内容 |
議決権の所有割合又は被所有割合 (%) |
関係内容 |
|
(連結子会社) |
|
|
|
|
|
|
Solasia Medical Information Consulting (Shanghai) Co. Ltd. |
中華人民共和国上海市
|
30,000千円 |
当社製品のマーケティング支援 |
所有 直接 100.0 |
役員の兼任 |
|
(その他の関係会社) |
|
|
|
|
|
|
JapanBridge (Ireland) Limited
|
アイルランド共和国クレア州 |
16,569 千ユーロ |
投資業 |
被所有 直接 43.9 |
当社への出資 |
|
Luxembourg Bridge S.à.r.l. |
ルクセンブルク大公国ルクセンブルク市 |
12 千ユーロ |
投資業 |
被所有 間接 43.9 |
JapanBridge (Ireland) Limitedへの出資 |
|
JapanBridge Delaware LLC
|
米国デラウェア州 |
15,344 千米ドル |
投資業 |
被所有 間接 43.9 |
Luxembourg Bridge S.à.r.l.への出資 |
|
伊藤忠商事株式会社(注) |
東京都港区
|
253,448 百万円 |
総合商社 |
被所有 直接 27.5 |
当社への出資、役員の派遣 |
(注)有価証券報告書を提出しています。
5【従業員の状況】
(1) 連結会社の状況
|
2017年1月31日現在 |
|
|
従業員数(人) |
|
|
16 |
|
(注)1.従業員数は就業人員です。
2.当社グループは単一セグメントであるため、セグメント情報との関連は記載していません。
(2) 提出会社の状況
|
2017年1月31日現在 |
|||
|
従業員数(人) |
平均年齢(歳) |
平均勤続年数(年) |
平均年間給与(千円) |
|
11 |
49.3 |
2.4 |
13,979 |
(注)1.従業員数は就業人員です。
2.平均年間給与は、賞与及び基準外賃金を含んでいます。
3.当社は単一セグメントであるため、セグメント情報との関連は記載していません。
(3) 労働組合の状況
労働組合は結成されていませんが、労使関係は円満に推移しています。